O que Provoca a Retinose Pigmentar? Uso da Luz como Ferramenta para Investigar a Morte Celular de Bastonetes com a Doença
A Revista Eletrônica PesquisABC possui o seguinte registro ISSN: 2675-1461
Julia de Almeida Pereira [a]*, Gabrieli Bovi dos Santos [a], Marília Inês Móvio [a], Mariana Sacrini Ayres Ferraz [a], Alexandre Hiroaki Kihara [a].
a Laboratório de Neurogenética, Centro de Matemática, Computação e Cognição, Universidade Federal do ABC, São Bernardo do Campo/SP
Resumo: A retinose pigmentar é uma retinopatia hereditária que causa a morte de fotorreceptores, iniciando pelos bastonetes, levando à perda de visão e, eventualmente, à cegueira. A mutação no gene da fosfodiesterase-6 (PDE6), especificamente em sua subunidade β, provoca acúmulo de cálcio intracelular e cGMP, ativando vias de morte celular como apoptose e necroptose. Este estudo, conduzido no Laboratório de Neurogenética da UFABC, buscou padronizar um modelo in vitro de neurodegeneração induzida pela luz em células com essa mutação para investigar os mecanismos de morte celular envolvidos. Culturas primárias mistas de retina de animais com e sem a mutação foram expostas à luz por até 5 horas. As culturas mutadas apresentaram queda na viabilidade após 5 horas de exposição, atribuída ao aumento da morte de bastonetes por necroptose e apoptose, com ativação inicial da necroptose. Culturas sem a mutação não apresentaram alterações na viabilidade. Ainda foram observadas mudanças morfológicas nas células gliais expostas à luz, indicando sua provável ativação. Os resultados mostram que a mutação aumenta a sensibilidade à neurodegeneração induzida pela luz, com ativação primária da necroptose e mudanças comportamentais nas gliais, contribuindo para o avanço no entendimento da doença e possíveis intervenções terapêuticas.
Palavras-chave: retina; retinose pigmentar; neurodegeneração; fosfodiesterase 6-beta; morte celular.
Abstract
Retinitis pigmentosa is a hereditary retinopathy that causes the death of photoreceptors, starting with rod cells, leading to vision loss and eventually blindness. A mutation in the phosphodiesterase-6 (PDE6) gene, specifically in its β subunit, triggers the accumulation of intracellular calcium and cGMP, activating cell death pathways such as apoptosis and necroptosis. This study, conducted at the Neurogenetics Laboratory of UFABC, aimed to standardize an in vitro model of light-induced neurodegeneration in cells with this mutation to investigate the mechanisms of cell death involved. Mixed primary retinal cultures from animals with and without the mutation were exposed to light for up to 5 hours. Mutated cultures showed a decrease in viability after 5 hours of exposure, attributed to increased rod cell death via necroptosis and apoptosis, with necroptosis being initially activated. Cultures without mutation showed no changes in viability. Analyses also revealed morphological changes in glial cells exposed to light, indicating their probable activation. The results demonstrate that the mutation increases sensitivity to light-induced neurodegeneration, with primary activation of necroptosis and behavioral changes in glial cells, contributing to the advancement of understanding the disease and potential therapeutic interventions.
Keywords: retinitis pigmentosa; retina; phosphodiesterase 6-beta; neurodegeneration, cell death.
*Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo. (e-mail do autor de correspondência)
ORCID ID: 0000-0003-3508-8615
Introdução
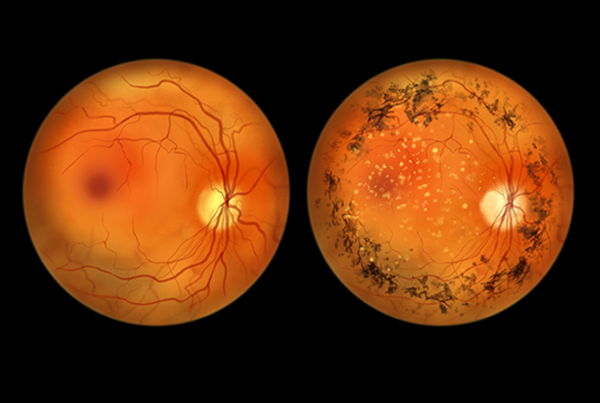
A retinose pigmentar (RP) é a principal causa de cegueira hereditária no mundo, afetando aproximadamente 1 a cada 4.000 pessoas no Brasil1. É uma doença que acomete a retina - estrutura localizada na região posterior do olho responsável por captar os sinais luminosos e transformar em sinais nervosos por um processo chamado de fototransdução. A RP afeta em especial as células fotorreceptoras do tipo bastonetes, provocando a morte dessas células e iniciando o mecanismo de ação da doença. A morte dos bastonetes leva a perda progressiva da visão, que em seu estágio inicial é caracterizada por uma perda inicial da visão noturna. Em um estágio intermediário, a cegueira noturna é perceptível e há redução na visão periférica, um fenômeno chamado de visão em túnel. Em estágios mais avançados, a doença progride até a perda completa da visão2. Assim, dada a natureza altamente debilitante e alta prevalência da doença, torna-se evidente a necessidade de estudos relacionados ao seu mecanismo de ação.
Diversas mutações podem provocar RP, entre elas uma mutação no gene que codifica a proteína fosfodiesterase 6-beta (PDE6b), essencial para o processo de fototransdução. Essa proteína é responsável por transformar monofosfato cíclico de guanosina (cGMP) em monofosfato de guanosina (GMP), provocando uma diminuição na quantidade de cGMP dentro da célula, o que faz com que ocorra uma menor interação de cGMP com canais iônicos CNG e leva ao fechamento desses canais. É por meio desses canais que os íons de cálcio e sódio entram na célula e, portanto, o fechamento deles causa uma diminuição na quantidade de íons que entram na célula, o que hiperpolariza o bastonete e desencadeia o processo de transmissão sináptica, ou seja, inicia-se a transmissão da informação visual recebida nos bastonetes para as demais células da retina em direção ao nervo óptico e ao cérebro, onde será processada e interpretada como as imagens que podemos ver. A mutação na proteína PDE6b causa mal funcionamento na fototransdução por não transformar adequadamente o cGMP em GMP, o que gera o acúmulo de cGMP e de cálcio intracelular. O excesso de cálcio intracelular é tóxico para as células e eventualmente leva à morte celular dos fotorreceptores bastonetes3,4. Esse fenômeno desencadeia a cascata de morte celular, neurodegeneração e neuroinflamação característicos da doença4.
Dentre as vias de morte celular observadas na RP, destacam-se a apoptose e a necroptose. A apoptose é conhecida como a morte celular programada e sem processo inflamatório associado, ou seja, é um processo coordenado pela própria célula e que leva a uma morte ‘limpa’. Ela pode ser provocada por fatores internos da célula ou por fatores externos, sendo uma resposta a estímulos que dizem que há algo de errado com a célula, como um mau funcionamento, e que ela deve ser ‘desativada’. O acúmulo de cálcio intracelular nos bastonetes pode ser um fator interno que provoca o processo de apoptose nos bastonetes, por exemplo. Apesar de diferentes estímulos iniciais poderem desencadear o processo apoptótico, a proteína caspase 3 é uma peça central da apoptose, sendo uma das caspases executoras, isto é, ao ser ativada, ela ‘manda’ a ordem para que o processo apoptótico de fato aconteça, levando a célula a reduzir seu tamanho e se dividir em pequenos fragmentos (chamados de corpos apoptóticos), que são coletados por células de defesa. Independente do estímulo inicial, a caspase 3 é sempre ativada na apoptose4.
A outra via de morte observada, a necroptose, é também conhecida como necrose programada, mas diferentemente da apoptose, ela é associada com processos inflamatórios, ou seja, não é uma morte ‘limpa’. A necroptose também surge em respostas aos estímulos que indicam que a célula apresenta algum problema, mas age mais rapidamente que a apoptose. Essa ‘pressa’ faz com que o processo não ocorra de forma tão ordenada quanto a apoptose e moléculas tóxicas podem ‘sobrar’ ou extravasar no processo. Esses compostos tóxicos acabam interagindo com outras células e podem até provocar reações ‘agressivas’ das células do sistema imune, o que causa uma inflamação na tentativa de frear a dispersão dos fragmentos tóxicos. O processo inflamatório da necroptose e os ‘resquícios’ podem provocar a morte de células ao redor. Assim como a apoptose, a necroptose também pode ser iniciada por diferentes formas e tem moléculas responsáveis por regular o processo, como a proteína quinase RIPK3. A fosforilação dessa proteína leva a ativação de outras moléculas que interagem com a membrana das células e formam poros nelas, provocando instabilidade na célula e sua morte4,5.
Os mecanismos de ação da RP ainda envolvem processos de ativação de células presentes na retina relacionadas ao sistema imune e de manutenção da integridade do tecido: as células da glia, divididas em astrócitos, células de Müller e microglias. As células da glia são ativadas em decorrência dos processos de morte celular e inflamação como uma tentativa de frear a neurodegeneração4,5,6.
O objetivo desta pesquisa conduzida no Laboratório de Neurogenética da UFABC foi padronizar um modelo in vitro de neurodegeneração induzida pela luz de retinose pigmentar, fazendo com que os mecanismos de morte tradicionais da doença aconteçam em um ambiente controlado e de forma acelerada, para que a investigação de possíveis alvos terapêuticos e a eficiência de fármacos seja investigada sem tantas variáveis quanto em modelos in vivo.
O trabalho na prática: métodos e resultados
Para esse trabalho, foram utilizadas as retinas de camundongos rd1 com a mutação da PDE6b (C3H/HeJ) e saudáveis (C57BL/6) com idades entre 0 e 3 dias (P0-P3). Os procedimentos metodológicos foram aprovados pela Comissão de Ética no uso de Animais de Laboratório da Universidade Federal do ABC (CEUA/UFABC). A retina extraída foi utilizada para a confecção de culturas celulares primárias mistas, ou seja, para cultura celular usando contendo todos os tipos celulares presentes nas retinas extraídas. As culturas foram mantidas in vitro por 11 dias, quando foram expostas ao estímulo luminoso para induzir a neurodegeneração característica da RP. As culturas de animais saudáveis foram usadas como controle, isso é, usadas como comparação do que acontece quando as células sem a mutação são expostas à luz e do que acontece nas células mutadas. Após a exposição a luz por 0, 2, 3 e 5 horas, em intensidade de 12 mil lux, foram feitas análises de viabilidade e morte celular, além de imunofluorescências, uma técnica que permite a análise da presença e da quantidade de compostos moleculares específicos nas culturas. Também foram feitas análises da morfologia de células da glia para analisar sua atividade e ativação no contexto do nosso modelo de neurodegeneração induzida pela luz.
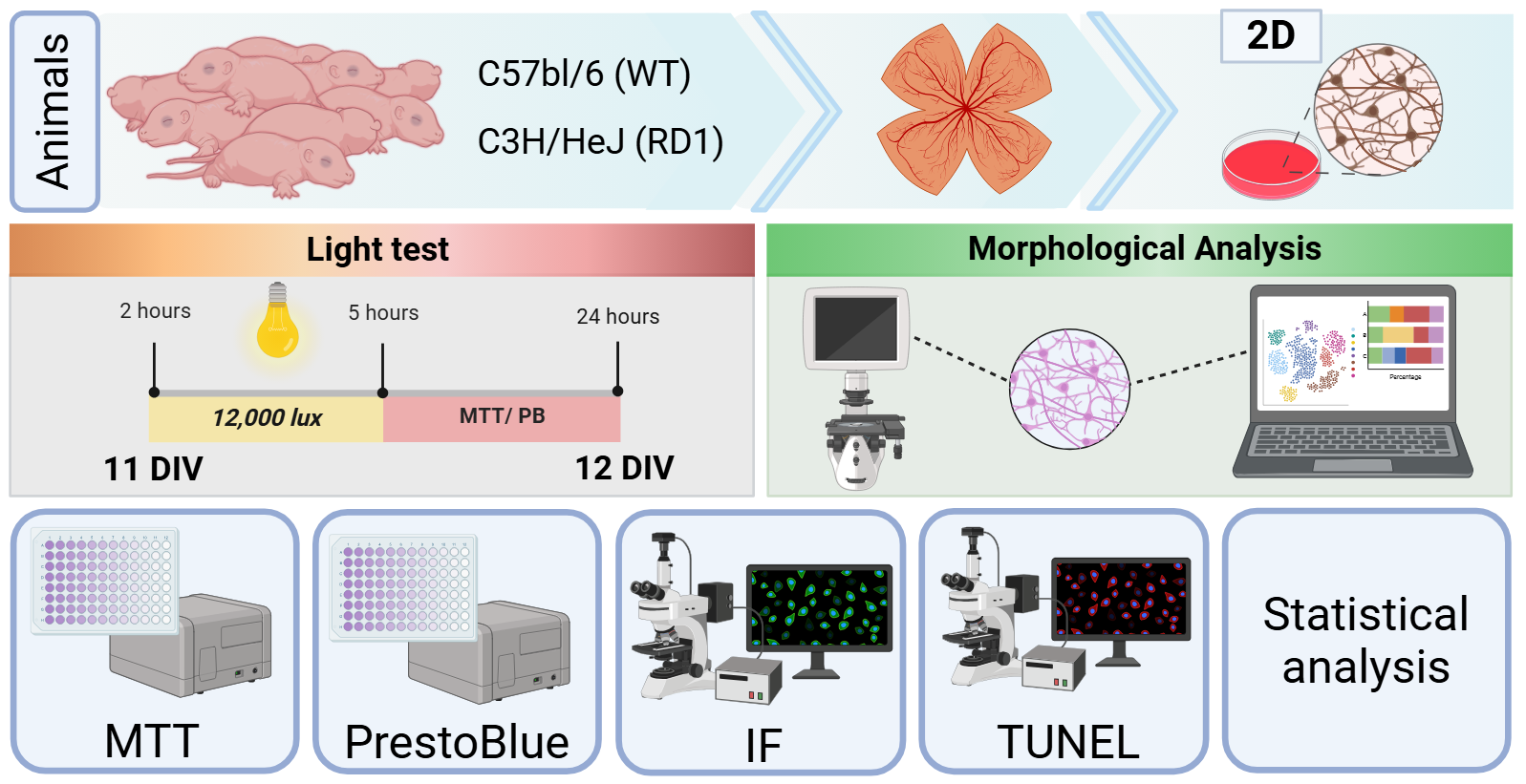
Figura 1. Metodologia do trabalho.
Os resultados da padronização do experimento de exposição das células à luz indicaram que as células saudáveis (WT) não apresentaram variações na viabilidade para nenhum tempo de exposição à luz, mas que as células com a mutação (rd1) apresentaram uma tendência de queda na viabilidade depois de 5 horas de exposição à luz. Para investigar se essa tendência de queda estava associada à morte celular, foi realizado ensaio de TUNEL. O ensaio de TUNEL indica células em processo de morte por apoptose, e a análise da quantidade de células marcadas por TUNEL em cada tempo de exposição à luz nas culturas de rd1 indicaram um aumento significativo desse marcador após 5 horas de luz, comparando com 2 horas e escuridão.
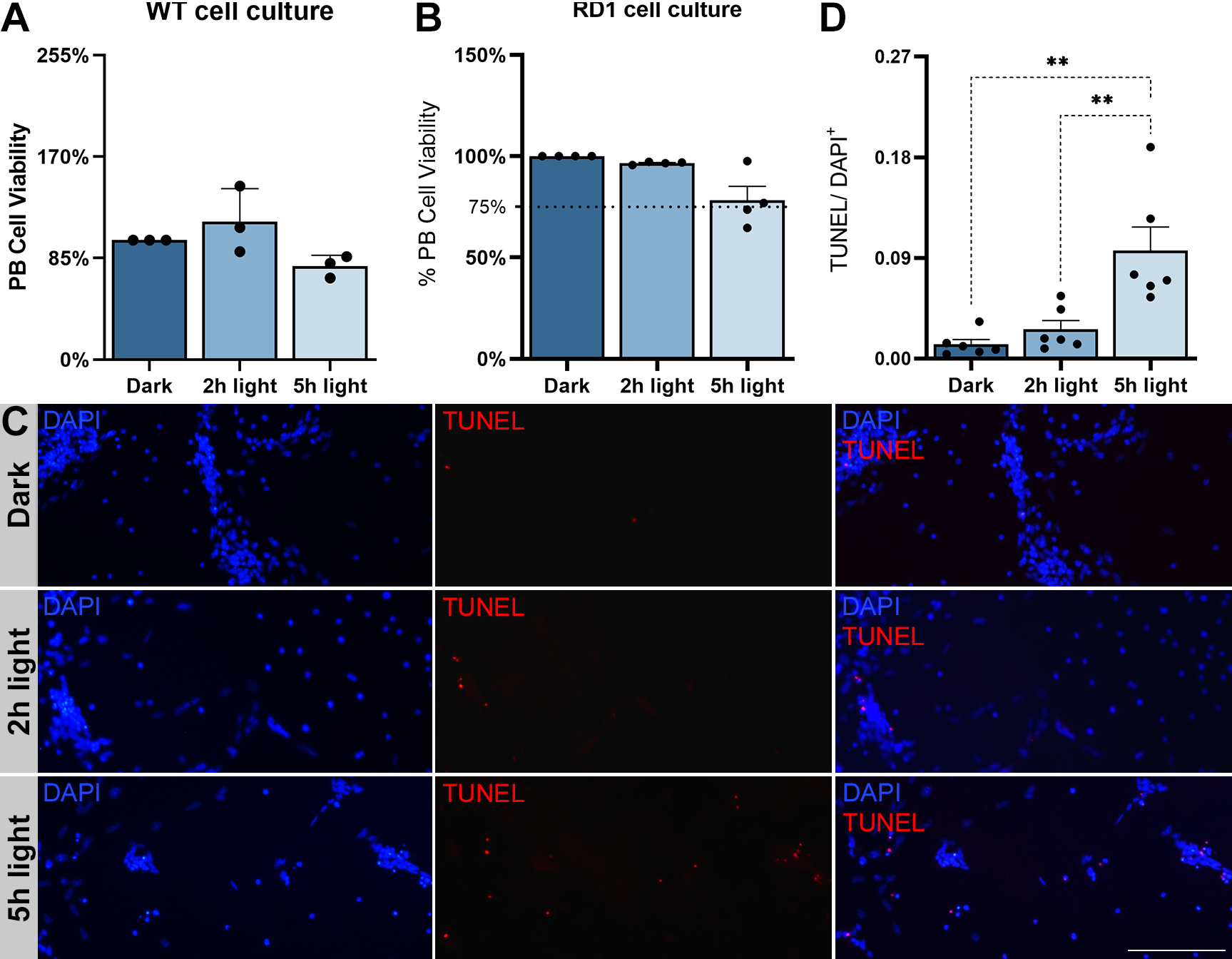
Figura 2. Análise de viabilidade e morte celular de células de retina de animais WT e RD1 expostas a 12.000 lux por 2 e 5 horas. (A) Quantificação de absorbância do ensaio de PrestoBlue (PB) em cultura de retina de animais saudáveis (C57BL/6). (B) Quantificação de absorbância do ensaio de PB em cultura de retina de animais RD1 (C3H/HeJ). (C) Culturas de células retinianas mantidas no escuro e expostas à luz com 12.000 lux por 2 e 5 horas com marcações de TUNEL e DAPI. (D) Quantidade de células positivas para TUNEL normalizada com a quantidade núcleos (positiva para DAPI). DAPI (4',6-diamidino-2-fenilindol). Barra de escala em 10 µm com aumento de 10x.
Para verificar se o aumento de morte celular relacionado com o tempo de exposição se referia a morte de fotorreceptores bastonetes, as primeiras células a morrerem na progressão normal da RP, foram feitos ensaios de imunofluorescência com o anticorpo rodopsina. A rodopsina é uma molécula característica de células fotorreceptoras do tipo bastonetes, e a imunofluorescência é uma técnica que nos permite adicionar uma molécula fluorescente a alguma molécula de interesse, no nosso caso a rodopsina, de forma que ela brilhe colorido quando observada no microscópio. Assim, a imunofluorescência foi realizada junto com ensaio de TUNEL e a análise dos resultados indicaram que houve um aumento de morte celular de bastonetes nas culturas expostas à 5 horas de luz em comparação com as não expostas (escuro).
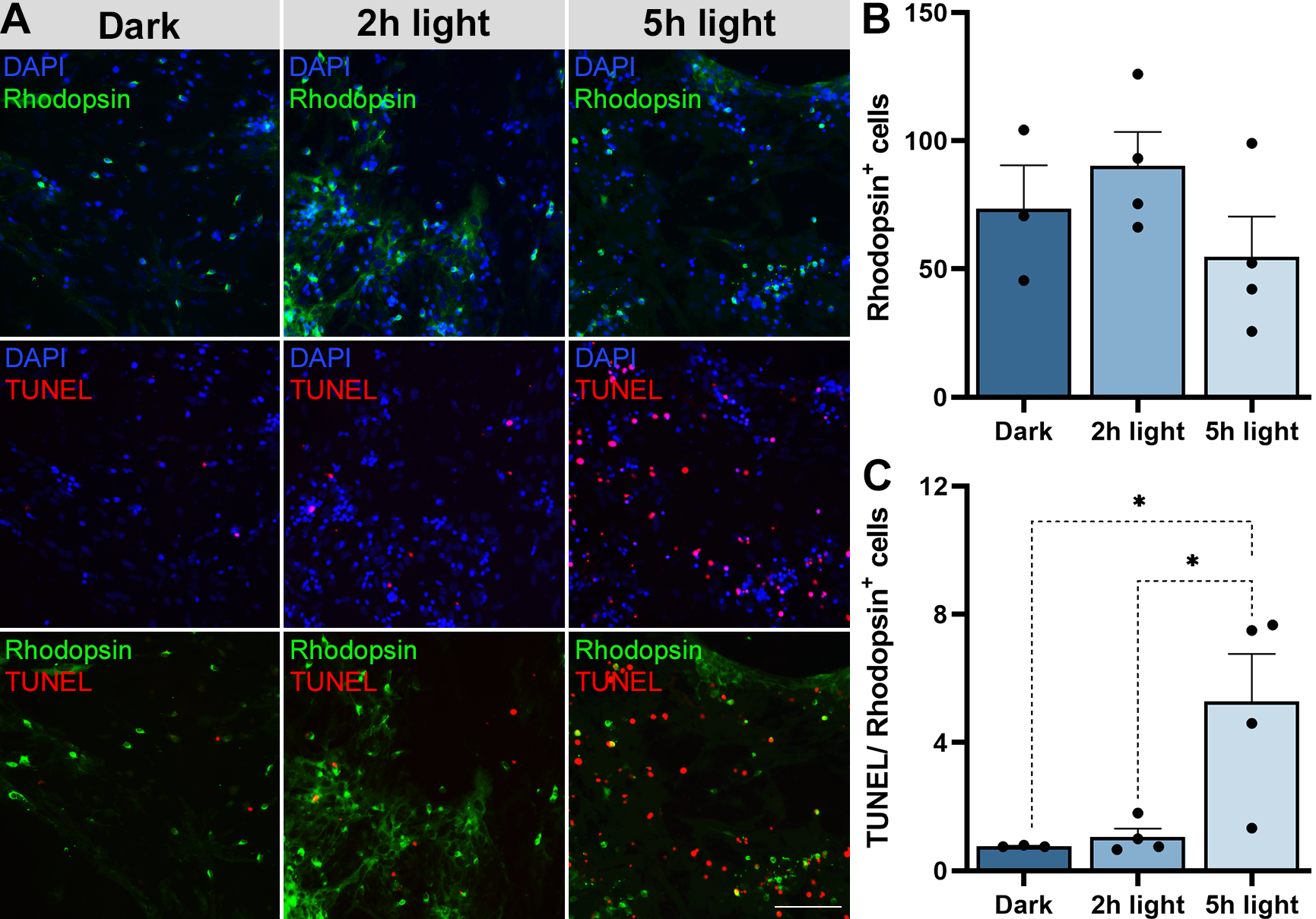
Figura 3. Análise de viabilidade e morte celular de fotorreceptores bastonetes em culturas de células de retinas de animais RD1 (C3H/HeJ). (A) Células de retina de animais RD1 com marcações de TUNEL, DAPI e imunofluorescência de Rodopsina em culturas no escuro e expostas a 12.000 lux de luz branca por 2 e 5 horas. (B) Quantidade de células positivas para Rodopsina em cada grupo. (C) Quantidade de células positivas para TUNEL e Rodopsina em cada grupo. DAPI (4',6-diamidino-2-fenilindol). Barra de escala em 5 µm com aumento de 20x.
Para analisar quais vias de morte celular estavam ocorrendo e quando estavam sendo ativadas, imunofluorescências de marcadores específicos da apoptose (caspase-3 ativada) e da necroptose (RIPK3 fosforilada) foram realizadas. As análises indicaram que o processo de morte por necroptose foi ativado com 3 horas de exposição à luz, enquanto a apoptose teria sido ativada somente após 5 horas, indicando que a necroptose foi ativada antes.
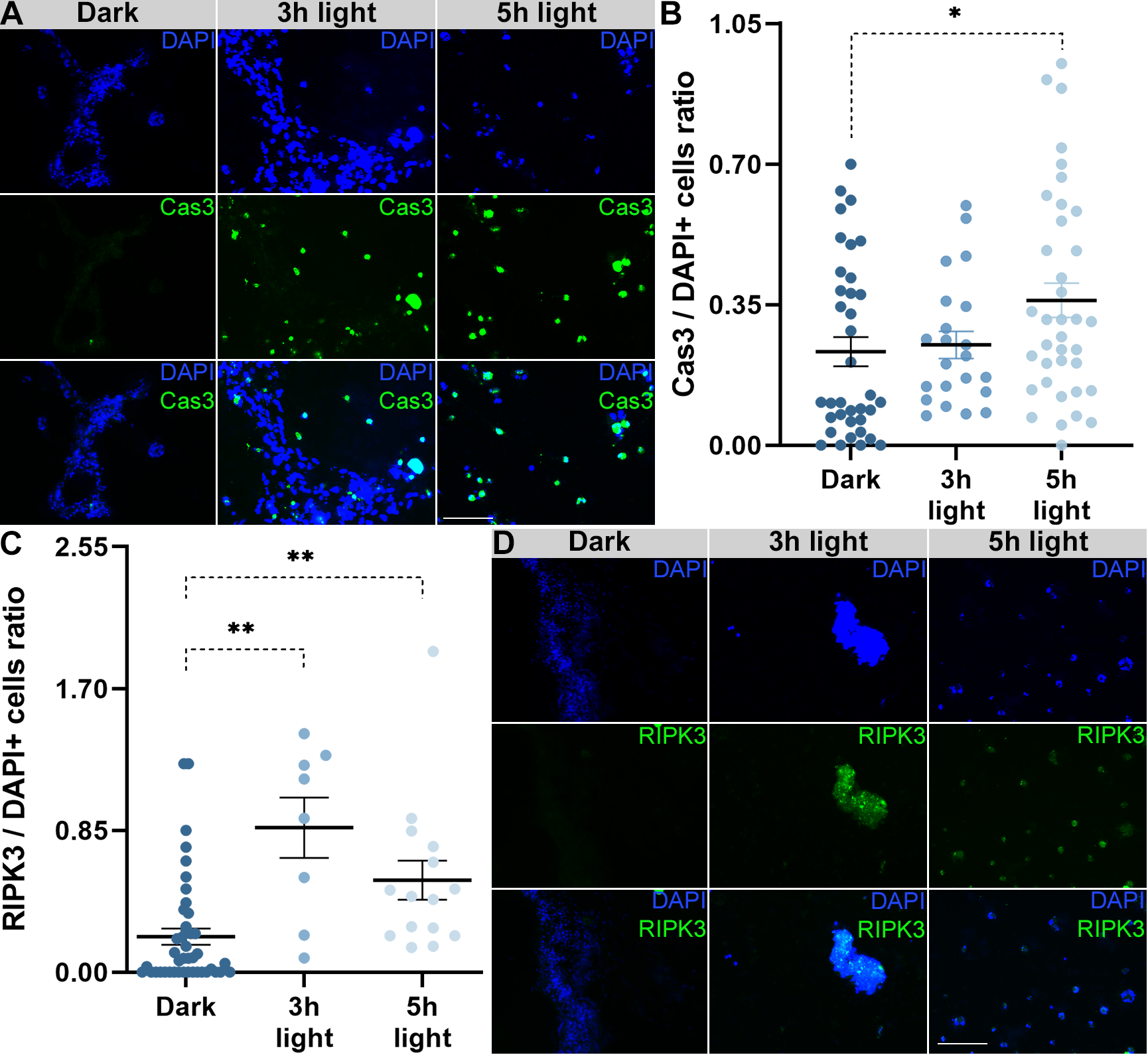
Figura 4. Análise das vias de morte celular em culturas de células de retinas de animais RD1 (C3H/HeJ). (A) Células de retina de animais RD1 com marcações de DAPI e imunofluorescência de Caspase-3 ativada em culturas no escuro e expostas a 12.000 lux de luz branca por 3 e 5 horas. (B) Quantidade de células positivas para DAPI e Caspase-3 ativada. (C) Quantidade de células positivas para DAPI e RIPK-3 fosforilada. (D) Células de retina de animais RD1 com marcações de DAPI e imunofluorescência de RIPK-3 fosforilada em culturas no escuro e expostas a 12.000 lux de luz branca por 3 e 5 horas. DAPI (4',6-diamidino-2-fenilindol). Barra de escala em 5 µm com aumento de 20x.
Como citado anteriormente, processos inflamatórios ocorrem em decorrência da morte celular e podem ativar as células da glia [4, 5]. Para analisar a atividade das células da glia nos tempos de exposição à luz, foram realizadas análises morfológicas que nos permitiram classificar os comportamentos das glias em cada tempo de exposição por meio de análises computacionais de dendrogramas e clusters. Essas análises indicaram que as glias observadas nas culturas em 0 (controle no escuro), 2 e 5 horas de exposição à luz apresentaram no geral 5 conformações diferentes, ou seja, se comportavam de 5 formas diferentes. Conforme o tempo de exposição à luz aumentou, a diversidade de comportamentos das glias diminuiu, de forma que com 5 horas de exposição mais de 60% das glias apresentavam a mesma conformação, ou seja, mesmo comportamento. Esse resultado indica que a exposição à luz causou uma ativação das células da glia in vitro proporcional ao tempo de exposição.
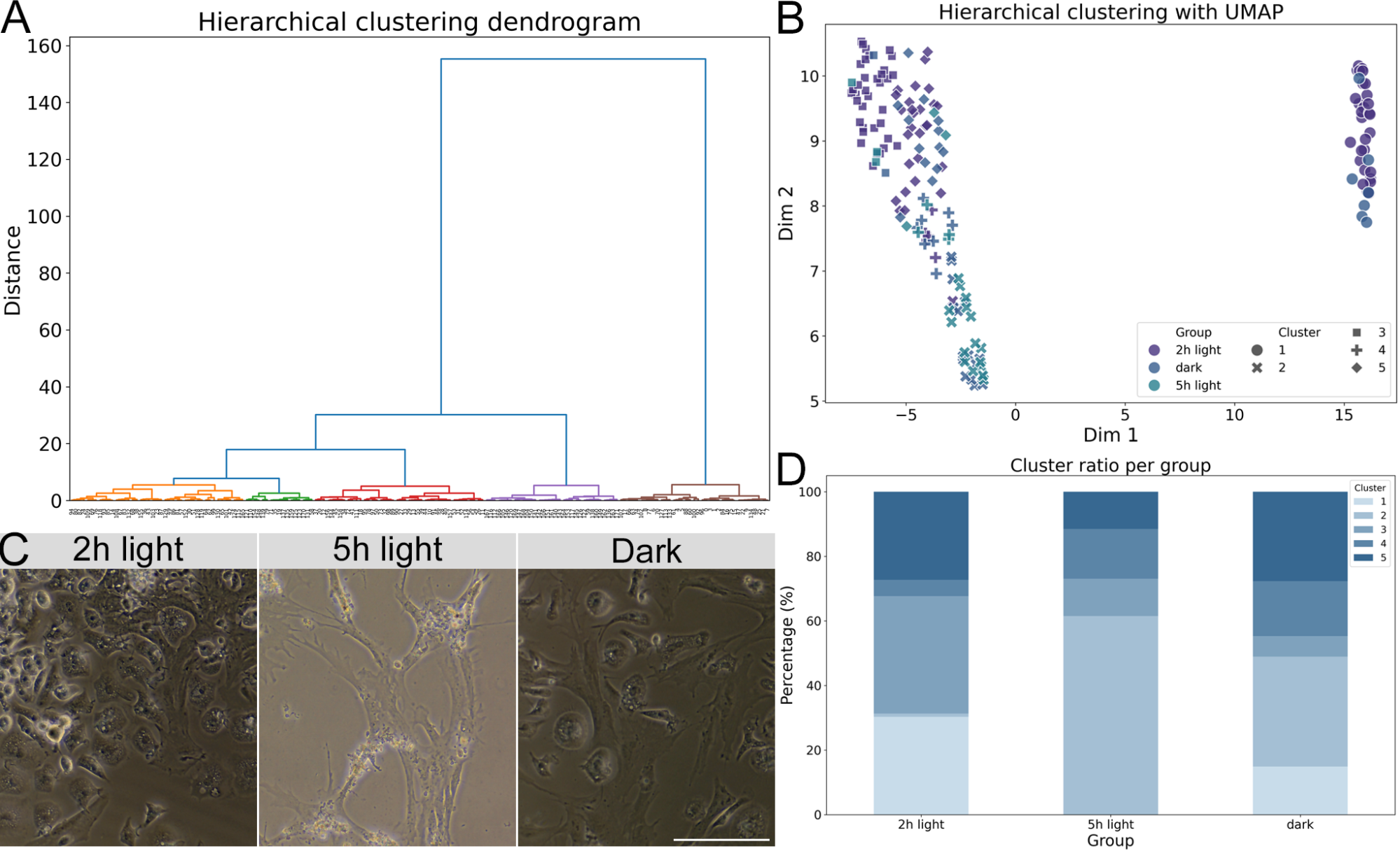
Figura 5. Análise morfológica das macroglias de culturas retinianas de animais RD1 (C3H/HeJ). (A) Dendrograma do agrupamento hierárquico. (B) Distribuição dos clusters por grupo experimental (C) Células da macroglia de animais C3H/HeJ nas condições 0h (escuro), 2h e 5h de exposição à luz de 12.000 lux de intensidade. (D) Proporção percentual dos subtipos morfológicos encontrados por grupo. Barra de escala em 5 µm com aumento de 20x.
Mas afinal, o que tudo isso significa?
Em conclusão percebemos que a mutação da PDE6b torna as células da retina, em particular os fotorreceptores bastonetes, mais sensíveis à neurodegeneração induzida pela luz quando comparadas às células saudáveis in vitro. Além disso, nosso modelo de indução pela luz parece de fato desencadear os processos de morte celular característicos da RP de forma acelerada em relação com o observado nos animais com a mutação, sendo que o ensaio também permitiu o reconhecimento de tempos de exposição de interesse para o desenvolvimentos de próximas pesquisas. A análise das vias de morte celular indicou que o processo de necroptose foi ativado previamente à apoptose, e que isso pode provocar a ativação de células da glia. Esses resultados poderão auxiliar o desenvolvimento de novos fármacos e abordagens terapêuticas para o tratamento da RP.
Agradecimentos
Agradecemos à Universidade Federal do ABC (UFABC), ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e à Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP 2020/11667-0 e 2021/14227-3) pelo apoio financeiro e pela oportunidade de realizarmos este estudo.
Referências
1. Queiroz, A. C. C. , Frasson, M., Veloso, C. E. R., Arantes, R. R., & Nehemy, M. B. Clinical study and pattern of inheritance in patients with retinitis pigmentosa. Rev. Bras. de Oftalmol. 72(1), 26-28 (2013).
2. Ali, M. U., Rahman, M. S. U., Cao, J., & Yuan, P. X. Genetic characterization and disease mechanism of retinitis pigmentosa; current scenario. 3 Biotech. 7(4), 251 (2017). https://doi.org/10.1007/s13205-017-0878-3
3. Iribarne, M., & Masai, I. Neurotoxicity of cGMP in the vertebrate retina: from the initial research on rd mutant mice to zebrafish genetic approaches. J Neurogenet. 31(3), 88–101 (2017). https://doi.org/10.1080/01677063.2017.1358268
4. Newton, F., & Megaw, R. Mechanisms of Photoreceptor Death in Retinitis Pigmentosa. Genes. 11(10), 1120 (2020). https://doi.org/10.3390/genes11101120
5. Huang, Z., Zhou, T., Sun, X. et al. Necroptosis in microglia contributes to neuroinflammation and retinal degeneration through TLR4 activation. Cell Death Differ. 25, 180–189 (2018). https://doi.org/10.1038/cdd.2017.141
6. Díaz-Lezama, N., Kajtna, J., Wu, J., Ayten, M., Koch, S. F. Microglial and macroglial dynamics in a model of retinitis pigmentosa. Vis. Res. 210, 108268 (2023). https://doi.org/10.1016/j.visres.2023.108268.

Redes Sociais