Como as Células da Retina Respondem à Inflamação? O Papel de IP3R1 na Gliose Reativa e Ativação Microglial
A Revista Eletrônica PesquisABC possui o seguinte registro ISSN: 2675-1461
Bruna de Albuquerque Menezes [a]*, Théo Henrique de Lima Vasconcellos [a], Marília Inês Móvio [a], Alexandre Hiroaki Kihara [a]
* Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo. - https://orcid.org/0009-0005-3992-7991
ªLaboratório de Neurogenética, Centro de Matemática, Computação e Cognição, Universidade Federal do ABC, São Bernardo do Campo/SP.
Resumo: A visão humana é mediada pela transformação de estímulos luminosos em sinais elétricos, processo que ocorre na retina, um tecido complexo e estruturado. Entretanto, perturbações na homeostase retiniana, como aquelas causadas pela retinose pigmentar, podem resultar em uma perda progressiva da visão devido à degeneração das células fotorreceptoras. Sob tais condições, células gliais, como as microglias e as células de Müller, desempenham papéis cruciais na resposta inflamatória, liberando fatores que, quando desregulados, podem agravar a degeneração. O cálcio intracelular atua como um regulador desses processos e uma das vias que está envolvido é pelo receptor IP3R1, destacando-se por sua relevância na sinalização celular retiniana. Uma investigação conduzida pelo Laboratório de Neurogenética da Universidade Federal do ABC buscou esclarecer o papel do IP3R1 na neuroinflamação retiniana. Utilizando modelos de cultura de células primárias de retinas de roedores, o estudo desenvolveu um modelo experimental denominado "Double Hit", que combina estímulos oxidativos para mimetizar a retinose pigmentar. Os resultados revelaram que a modulação do IP3R1 pelo 2-APB reduziu a ativação microglial e promoveu um perfil anti-inflamatório. Ainda, evidenciou-se o potencial de modulação dos astrócitos e neurônios com uso do fármaco, sugerindo uma estratégia promissora para o tratamento de condições neurodegenerativas.
Palavras-chave: neuroinflamação; IP3R1; microglia; células de Müller; retina.
Abstract: Human vision is mediated by the transformation of luminous stimuli into electrical signals, a process that occurs in the retina, a complex and structured tissue. However, disturbances in retinal homeostasis, such as those caused by retinitis pigmentosa, can result in progressive vision loss due to the degeneration of photoreceptor cells. Under such conditions, glial cells, such as microglia and Müller cells, play crucial roles in the inflammatory response by releasing factors that, when dysregulated, can exacerbate degeneration. Intracellular calcium acts as a regulator of these processes, and one of the pathways involved is through the IP3R1 receptor, notable for its relevance in retinal cell signaling. An investigation conducted by the Neurogenetics Laboratory at the Federal University of ABC sought to elucidate the role of IP3R1 in retinal neuroinflammation. Using primary cell culture models of rodent retinas, the study developed an experimental model called "DoubleHit," which combines oxidative stimuli to mimic retinitis pigmentosa. The results revealed that modulation of IP3R1 by 2-APB reduced microglial activation and promoted an anti-inflammatory profile. Furthermore, the potential modulation of astrocytes and neurons with the use of the drug was evidenced, suggesting a promising strategy for the treatment of neurodegenerative conditions.
Keywords: neuroinflammation; IP3R1; microglia; Müller cells; retina.
Introdução
Você já ouviu falar que nossa visão pode ser comparada com uma máquina fotográfica? Na parte interna do olho, há um tecido chamado retina, que é responsável por transformar a luz que chega aos nossos olhos em sinais elétricos que são decodificados pelo cérebro e interpretados como as imagens que vemos. A retina é um conjunto de camadas de células conectadas umas às outras, e com uma estrutura bem definida (1). Considerando sua boa organização, o que pode acontecer para que algumas pessoas percam sua visão ao longo da vida?
Algumas doenças, como a retinose pigmentar, causam uma perda progressiva da visão ao longo dos anos, podendo causar uma cegueira irreversível. A retinose afeta diretamente as células fotorreceptoras, responsáveis pela captação da energia luminosa (2). A retina é um tecido complexo e bem organizado, e possui células responsáveis por perceber mudanças na homeostase do tecido e gerar uma resposta para que a lesão seja controlada. Essas células são chamadas de células gliais, que podem ser microglias ou macroglias. As células de Müller são um tipo de macroglia presentes na retina. Juntamente com as microglias, essas células são capazes de liberar diversos fatores inflamatórios para controlar lesões (3). Porém, quando em excesso, esses fatores podem causar um efeito contrário e piorar o quadro inflamatório. Assim, é importante entendermos como essas células funcionam em diferentes situações.
O desequilíbrio na homeostase do tecido, causado por lesões ou doenças, pode resultar em um estresse oxidativo, levando à ativação das células da glia (3, 4). Essa ativação desencadeia a liberação de fatores inflamatórios na tentativa de retomar o equilíbrio do tecido. Um dos principais reguladores desse processo é o cálcio intracelular, que controla diversos mecanismos celulares na retina, desde o desenvolvimento até a morte celular. O cálcio tem sua ação em vias/receptores específicos, como é o caso da IP3. Esse receptor possui três subtipos, entre eles o IP3R1 desempenha um papel importante para o funcionamento das células nervosas (5).
Dessa forma, compreender como o IP3R1 está relacionado com o processo inflamatório pode nos ajudar a encontrar formas de terapias celulares eficazes contra diversas doenças que causam essa desregulação iônica, como a retinose pigmentar. Assim, o laboratório de Neurogenética da Universidade Federal do ABC desenvolveu uma pesquisa focada em investigar o papel dos receptores IP3R1 na neuroinflamação retiniana, analisando as respostas das células gliais sob estresse oxidativo, explorando os efeitos do bloqueio farmacológico com 2-aminoetoxidifenil (2-APB). Mas afinal, de que forma isso foi feito?
Desenvolvimento do trabalho
Nesta pesquisa, foram utilizados ratos da linhagem Long Evans, camundongos da linhagem C57BL/6 e rd1 (C3H/HeJ). Essas linhagens de roedores englobam tanto animais selvagens e saudáveis (Long Evans e C57BL/6), como aqueles que possuem o quadro de retinose (rd1). Os animais com idade de 0 a 4 dias pós-natais, machos e fêmeas, foram manuseados conforme as diretrizes éticas estabelecidas pelo Comitê de Ética da Universidade Federal do ABC (CEUA). Após a extração da retina, nosso tecido de interesse, foram feitas culturas de células primárias, mistas e puras de microglias e Müller, mantidas em meio de cultura adequada até os tratamentos, incluindo o fármaco. Os grupos experimentais realizados foram culturas de células tratadas com veículo ou fármaco, após exposição aos estímulos de estresse oxidativo. Em seguida foram feitas análises morfológicas e estatísticas para entender tais mudanças.
Um dos maiores achados de nosso trabalho foi a padronização do modelo que chamamos de DoubleHit nas culturas retinianas. DoubleHit, do inglês “Estímulo Duplo”, que combina dois estímulos nocivos para aumentar a sensibilidade das células ao estresse oxidativo. Com esse modelo, usamos o peróxido de hidrogênio (50 µM) como primeiro “hit” para induzir o estresse oxidativo por 24h, seguido do etanol (50 mM) como um agente estressor para os mecanismos imunolóogicos. Essa maior sensibilidade é observada no quadro de retinose pigmentar e, assim, pode ser um modelo interessante para mimetizar o quadro inflamatório da retinose.
E, de fato, o desenvolvimento desta técnica gerou uma maior reatividade glial tanto em culturas mistas como puras. Demonstrando o sucesso no modelo criado (Figura 1).
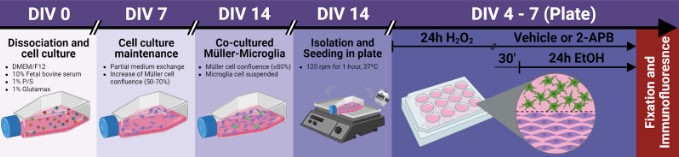
Figura 1 - modelo experimental de culturas puras e DH aplicado. Em 0 dias in vitro (DIV) as células foram dissociadas e semeadas em barca T-75, com manutenção em 7 dias. Em DIV14 é obtida uma co-cultura primária de células de Müller e microglia, onde isolamos e semeamos em placas de 24 e 48 poços, aplicando o DH em 4 dias pós-plaqueamento
Posteriormente, essas culturas que passaram pelo DoubleHit (DH) foram tratadas com o inibidor 2-APB ou seu veículo. Os resultados mostraram um aumento significativo no número de células microgliais do grupo DH em comparação com o grupo controle, células que não passaram por nenhum estímulo de estresse oxidativo. Já o tratamento com o bloqueador farmacológico IP3R1 (2-APB) reverteu essa diminuição, sugerindo sua capacidade de modularizar a resposta microglial.
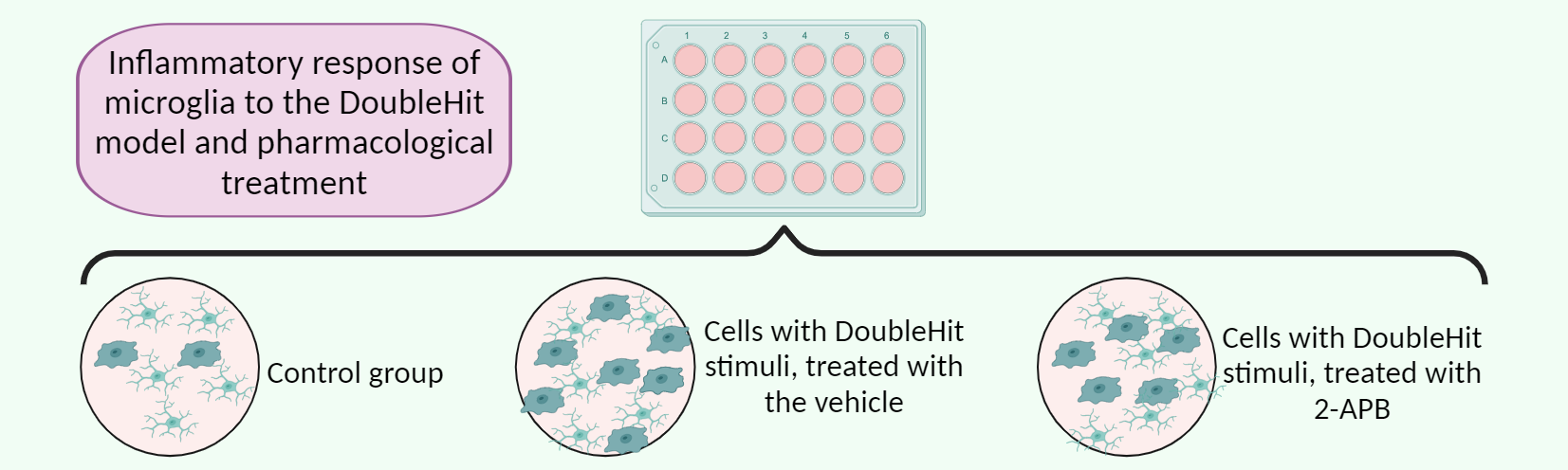
Figura 2 - desenho da resposta inflamatória microglial no modelo DoubleHit e tratamento farmacológico.
Em seguida, observamos alterações na morfologia celular em resposta a estímulos, com o tratamento 2-APB restaurando parcialmente esses parâmetros. A morfologia das células da microglia podem auxiliar na observação de um evento importante para essas células: seu estado de repouso (resting, ramificada) e seu estado inflamatório ativado (activated, amebóide). Ainda, este estado de ativação pode ser classificado pelo fenótipo expresso: anti- ou pró-inflamatório. Os resultados morfológicos indicaram um aumento na ativação microglial com a aplicação dos estímulos do DH. Apesar disso, houve um aumento no número de células que expressam o marcador anti-inflamatório (CD206) pós-tratamento com 2-APB, sugerindo uma mudança no perfil fenotípico da microglia para um estado anti-inflamatório. Estes resultados sugerem que, apesar da intensificação da ativação microglial e da neuroinflamação com estímulos duplos, a obstrução do IP3R1 pode modularizar essas respostas, levando a um perfil fenotípico mais anti inflamatório das microglias.
O estudo também examinou o papel das macroglias na resposta neuroinflamatória, com foco nas células de Müller e nos astrócitos no modelo DH. Apesar dos resultados obtidos para as células de Müller não serem estatisticamente significativos, a marcação astrocitária indicou que suas ramificações foram reduzidas quando comparamos controle e tratamento. Este efeito foi parcialmente atenuado com a aplicação 2-APB, sugerindo que essas células também possuem um envolvimento na inflamação induzida pelo DH, além de indicar um potencial de modulação desses efeitos pelo 2-APB.
Finalmente, examinamos o efeito do modelo DH em neurônios. Nosso estudo indicou um possível efeito neuroprotetor do bloqueio do IP3R1 no modelo de DH. Foram observados um maior número de células neuronais nas condições tratadas com 2-APB, além de morfologia mais preservada e ramificada, além disso, um número maior de células fotorreceptoras foi observado.
Conclusão
Assim, podemos concluir que o modelo DH pode mimetizar uma neurodegeneração das células da retina in vitro, e temos que o bloqueio do IP3R1 apresentou uma influência em diversos tipos celulares, como as microglias, os astrócitos e neurônios, diminuindo os efeitos da neuroinflamação e provendo proteção às células neuronais. Esse estudo abre portas para exploração do uso de 2-APB como possível alvo terapêutico em doenças neurodegenerativas da retina, mas para isso, seriam interessantes estudos futuros que possam explorar ainda mais os mecanismos subjacentes e o potencial terapêutico dessas intervenções em condições neurodegenerativas, como por exemplo, utilizar este fármaco em modelos animais de experimentação, ensaios in vivo, uma vez que as análises realizadas aqui foram feitas em culturas primárias de retina, que apresentam algumas limitações, como a simplificação da estrutura da retina e a quebra da complexidade desse tecido em camadas. Esse ambiente controlado nos permite fazer observações específicas, mas não reproduz totalmente as condições in vivo.
Agradecimentos:
Gostaríamos de agradecer ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e à Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP 2020/11667-0) pelo apoio financeiro e à Universidade Federal do ABC (UFABC) pela oportunidade de realizarmos este estudo.
Referências bibliográficas:
1. García-Bermúdez MY, Freude KK, Mouhammad ZA, van Wijngaarden P, Martin KK, Kolko M. Glial Cells in Glaucoma: Friends, Foes, and Potential Therapeutic Targets. Frontiers in Neurology. 2021 Mar 16;12:169.
2. Furtado CM, Móvio MI, Nishio, LH, Walter LT, Kihara, AH. Um Olhar Sobre A Retinose Pigmentar. Instituto Nanocell, 2015 Nov. DOI: http://dx.doi.org/10.15729/nanocellnews.2015.11.03.001
3. Simpson, Dominic S. A., and Peter L. Oliver. 2020. "ROS Generation in Microglia:
Understanding Oxidative Stress and Inflammation in Neurodegenerative Disease"
Antioxidants 9, no. 8: 743. https://doi.org/10.3390/antiox9080743
4. I. Lopategui Cabezas, A. Herrera Batista, G. Pentón Rol. The role of glial cells in
Alzheimer disease: potential therapeutic implications. Neurología (English Edition),
Eslevier. June 2014. DOI: https://doi.org/10.1016/j.nrleng.2012.10.009
5. Korvers L, de Andrade Costa A, Mersch M, Matyash V, Kettenmann H, Semtner M.
Spontaneous Ca2+ transients in mouse microglia. Cell Calcium. 2016;60(6):396-406.
doi:10.1016/j.ceca.2016.09.004

Redes Sociais