Transformação Genética e Acúmulo das Cadeias do Anticorpo Monoclonal Humano Adalimumabe em Microalga

A Revista Eletrônica PesquisABC possui o seguinte registro ISSN: 2675-1461
Ednilson Donisete de França Junior [a] , Lívia Seno Ferreira Camargo [a]*
[a] Universidade Federal do ABC
Resumo: Com o advento da tecnologia do DNA recombinante, surgem diversas plataformas para a produção de biomoléculas comerciais e uma nova perspectiva de produção industrial. Os anticorpos monoclonais, uma destas biomoléculas, vem sendo amplamente utilizados para tratamentos com alta especificidade, sendo aplicado no desenvolvimento da área terapêutica. Buscando plataformas alternativas capazes de sintetizar proteínas recombinantes complexas como anticorpos monoclonais, é proposta a síntese de adalimumabe na microalga Chlamydomonas reinhardtii.
Palavras-chave: microalga; proteínas recombinantes; anticorpos.
Abstract
With the advent of recombinant DNA technology, several platforms for the production of commercial biomolecules and a new perspective for industrial production have emerged. Monoclonal antibodies, one of these biotechnological products, has been widely used for treatments with high specificity, being applied in the development of the therapeutic area. Searching for new alternative platforms capable of synthesizing complex recombinant proteins such as monoclonal antibodies, the synthesis of this functional biomolecule in the microalgae Chlamydomonas reinhardtii is proposed.
Keywords: microalgae; recombinant proteins; antibodies.
ORCID ID https://orcid.org/0000-0002-6870-1220
A revolução do DNA recombinante
A descoberta da técnica do DNA recombinante foi um dos grandes adventos científicos que impactaram as ciências aplicadas à sociedade. A tecnologia do DNA recombinante compreende um conjunto de metodologias que permitem a manipulação genética planejada e específica. Um dos princípios da biologia molecular, que emergiu da descoberta do DNA e das diversas técnicas moleculares associadas, é de que o código genético é universal. Este conceito nos diz que, para todos os organismos vivos a informação genética, contida no DNA, segue um mesmo padrão de construção, que será codificado de forma semelhante e consistente por toda a diversidade da vida. Desta forma, com ao advento da tecnologia do DNA recombinante, tornou-se possível realizar modificações genéticas complexas, como por exemplo, o isolamento do gene de um organismo para inserção no genoma de um segundo organismo, permitindo com que este último decodifique a sequência gênica exógena, isto é, que tem uma origem externa ao organismo. Estes conhecimentos vêm sendo utilizados para estudar mecanismos celulares, determinar sequências genéticas, modificar genes, realizar diagnósticos genéticos, compreender a expressão genômica, alterar sistemas metabólicos, e diversas outras frentes, havendo um alto potencial aplicado.
Uma das áreas mais impactadas com o surgimento da técnica de DNA recombinante foi a de produção de biomoléculas, destacando proteínas terapêuticas e vacinas. Antes do surgimento desta tecnologia, as biomoléculas, em destaque proteínas, eram obtidas a partir do extrato dos organismos que as produziam. Podemos citar como exemplo a produção de insulina, um hormônio proteico que permite o controle da glicemia (taxa de glicose no sangue), que antes era extraído a partir do pâncreas de porcos e bois. Com o avanço das técnicas de modificação do DNA, a insulina humana passou a ser produzida por fermentação bacteriana, onde o DNA do gene humano da insulina, foi inserido na bactéria para que essa codifique a proteína de interesse utilizando sua maquinaria celular. Logo, a indústria se viu capaz de produzir, em larga escala e em menor tempo, diversas proteínas terapêuticas recombinantes de alta demanda comercial em diferentes organismos, sendo estes denominados de plataformas de expressão recombinante.
O que são anticorpos monoclonais?
Os anticorpos, que também podem ser denominados como imunoglobulinas, são grandes proteínas produzidas pelo sistema imunológico. Sua estrutura possui quatro cadeias polipeptídicas (unidades proteicas), duas cópias de cadeia leve e duas cópias de cadeia pesada (figura 1). Estas moléculas são capazes de interagir de forma específica com outras moléculas denominadas de antígenos. Cada anticorpo tem a especificidade por um determinado antígeno, isto é, a afinidade de interação é específica para a molécula alvo. A interação com o antígeno possibilita que o sistema imunológico efetue função para combate antígenos ou os agentes ao qual o antígeno faz parte. Os anticorpos são muito importantes para nossa resposta imunológica, pois é através deles que nosso corpo cria uma memória imunológica contra doenças causadas por agentes ao qual fomos expostos.
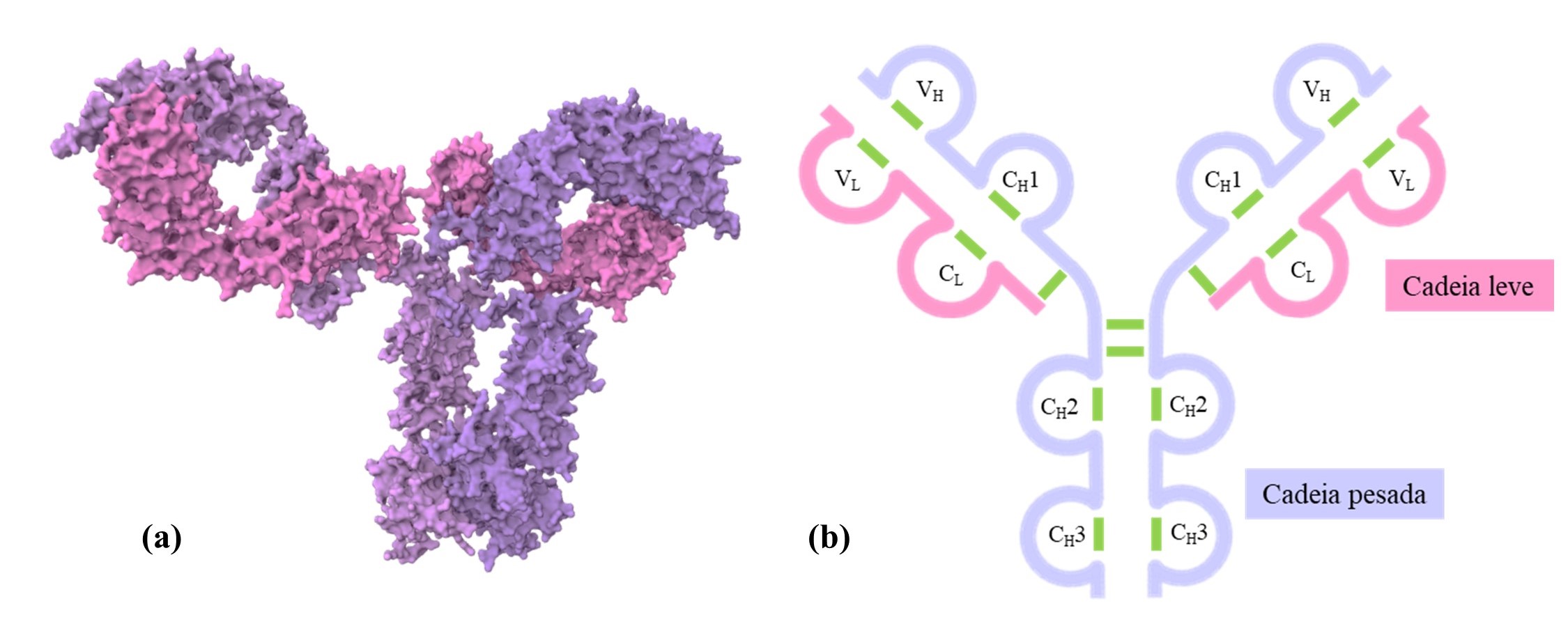
Figura 1. Esquema de anticorpos IgG. (a) Superfície molecular de um anticorpo monoclonal IgG humano (pbd: 1HZH). (b) Esquema estrutural de um anticorpo monoclonal. Em verde são destacadas as pontes dissulfeto formadas na estrutura.
Havendo o conhecimento sobre a especificidade de interação de um anticorpo e antígeno, estes podem ser aplicados como uma ferramenta médica, como em terapias contra o câncer, tratamento de doenças autoimune, infecções e diagnósticos. Com esta perspectiva de aplicação, surge o mercado de anticorpos “monoclonais”, produzidos de forma recombinante. O termo “monoclonais”, se refere a origem do anticorpo produzido, sendo derivado de um único tipo de célula imunológica B, deste modo, todos os anticorpos produzidos apresentam a mesma estrutura e interação com o mesmo alvo molecular.
Atualmente, a produção de anticorpos monoclonais comerciais é restrita a plataformas de expressão bem estabelecidas, como bactérias, leveduras e células de mamíferos. Apesar do cenário atual ter como foco a produção utilizando as plataformas de expressão mencionadas anteriormente, estudos vêm se desenvolvendo e contribuindo para estabelecer alternativas eficientes e que trazem outras vantagens ao processo de produção.
Microalgas como plataforma de expressão recombinante
As microalgas são organismos unicelulares ou pluricelulares, que possuem diferentes aspectos morfológicos e ocupam uma alta diversidade de ambientes. Entre elas há a microalga Chlamydomonas reinhardtii, uma alga unicelular fotossintetizante que apresenta cerca de 10 µm e um par de flagelos para locomoção. Esta microalga é um modelo amplamente utilizado para estudos de expressão de proteínas recombinantes, além de outras áreas. Entre as características atribuídas a esta microalga, e que podem ser projetadas positivamente para a indústria de produção de proteínas recombinantes, podemos mencionar: a classificação como GRAS (Generally recongnized as safe); capacidade fotossintética, permitindo aplicar um viés sustentável; o crescimento celular rápido quando comparado a plataformas de crescimento não microbiano; as poucas exigências de cultivo e custo de produção, quando comparado a sistemas como leveduras e células de mamíferos; e a ampla diversidade metabólica.
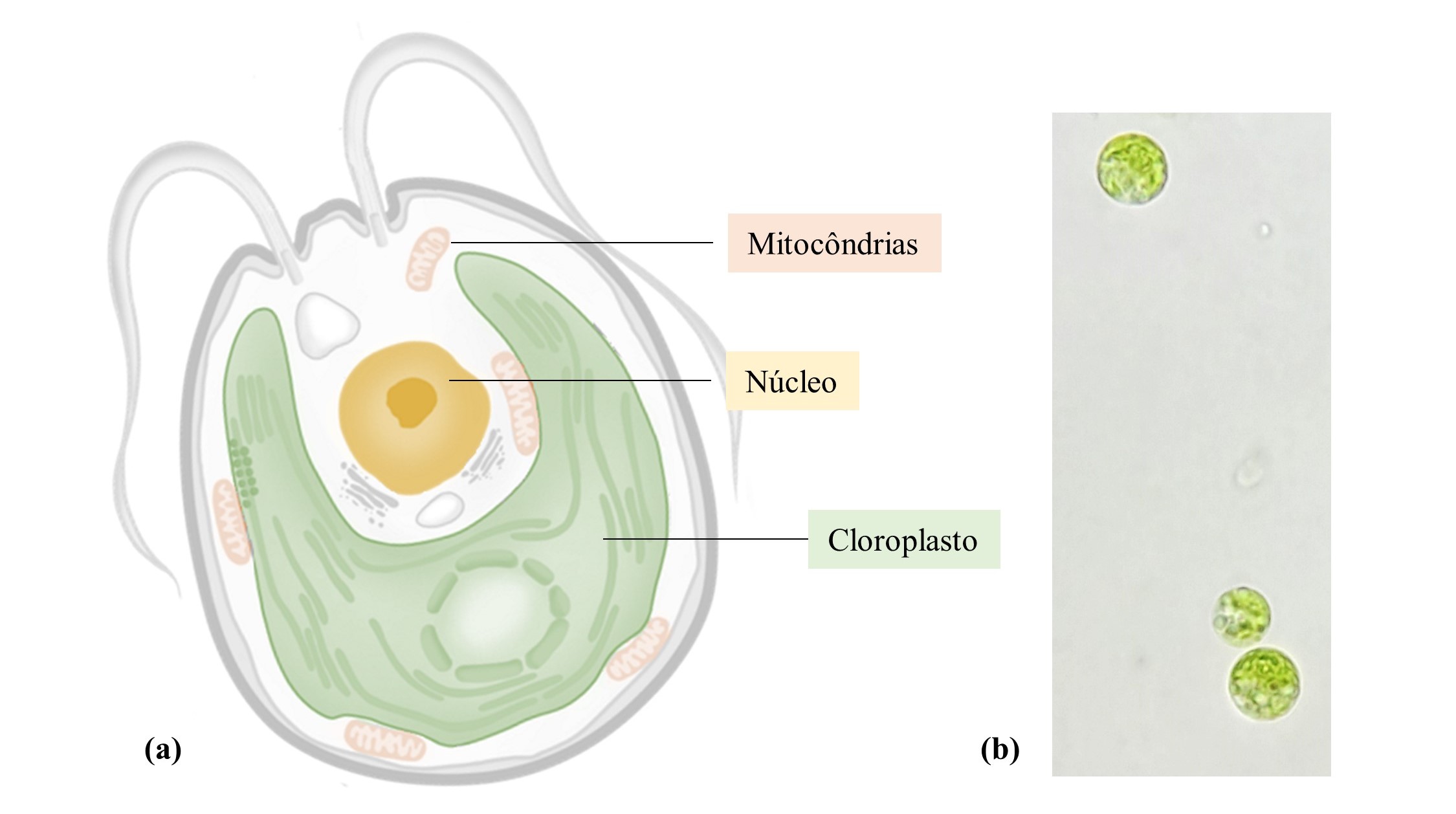
Figura 2. Chlamydomonas reinhardtii. (a) Esquema estrutural da microalga C. reinhardtii, destacando as organelas que possuem DNA. (b) Imagem de microscópio ótico, em amplitude ocular de 100X.
Esta microalga vem sendo utilizada para síntese de recombinantes resultante da modificação de seus três genomas: o genoma do cloroplasto, uma organela responsável pela fotossíntese; o genoma da mitocôndria, uma organela que se destaca pela produção de energia química para a célula; e o genoma do núcleo (figura 2). A produção recombinante através da modificação genética do cloroplasto vem ganhando bastante destaque, pois esta é uma organela que pode ocupar até 70 % do volume celular, possui uma alta quantidade de cópias genômicas, e possui uma maquinaria proteica capaz de auxiliar o dobramento da proteína de interesse. A primeira transformação genética realizada no genoma do cloroplasto de C. reinhardtii foi realizada 1980, e desde então pouco mais de 100 proteínas diferentes foram expressas de forma bem sucedida 1.
Expressão de anticorpos monoclonais em microalga
Apesar da quantidade de estudos para expressão recombinante em microalga estar aumentando, quando comparado a outras plataformas, é nítido que a construção do conhecimento para síntese nesta plataforma recombinante está no começo. Entretanto, já é estabelecido que a plataforma tem capacidade de sintetizar proteínas complexas como anticorpos, imunotoxinas e antitoxinas. A expressão de um anticorpo monoclonal completo é bastante desafiadora considerando o tamanho do transcrito e do produto proteico, além de existir uma conformação complexa a ser estabelecida para adquirir capacidade funcional. Para Chlamydomonas reinhardtii, foi descrito a produção de apenas dois anticorpos monoclonais humanos produzido a partir da recombinação genica do genoma do cloroplasto. O primeiro anticorpo sintetizado nesta microalga era um anticorpo monoclonal humano IgA anti-herpes (glicoproteína D), em uma síntese de cadeia polipeptídica única contendo ambas as cadeias do anticorpo2. Em 2009, Tran e colaboradores realizaram a expressão de um anticorpo humano IgG1 (anti-antraz), no cloroplasto de Chlamydomonas reinhardtii, demonstrando que a maquinaria da microalga foi suficiente para produzir um anticorpo funcional 3. Ambas as sequências gênicas de cadeia leve e pesada do anticorpo produzido, foram planejadas para que fossem reguladas polo promotor fotossintético chamado psbA. Este promotor é uma sequência genética de regulação endógena, isto é, presente na microalga e relacionado a síntese de uma proteína da fotossíntese.
No projeto desenvolvido no Laboratório de Biotecnologia Verde na UFABC pelo aluno de iniciação científica Ednilson D. França Junior, e orientado pela Profª Drª Lívia Seno Ferreira Camargo, é proposta a expressão de um anticorpo IgG humano, Adalimumabe, utilizando os promotores fotossintéticos psbD e psbA, para regular a síntese das cadeias dos anticorpos. Um dos grandes desafios apontados na literatura, está na dificuldade de expressão competitiva de anticorpos utilizando a microalga C. reinhardtii, abrindo possibilidade para otimização tanto a nível de mudança na configuração gênica, quanto na otimização dos parâmetros de cultivo e purificação. Estas informações impulsionam a investigação na síntese de novos anticorpos e de promotores alternativos associados a regulação da expressão proposta no projeto.
A citocina TNF-α, produzidas pelas células do sistema imunológico, alimentam o processo de inflamação, onde a citocina compreende o topo da cascata inflamatória. O adalimumabe é um anticorpo monoclonal que atua neutralizando TNFα solúvel e ligado a membrana, podendo ser utilizado para tratamento anti-TNFα, como em casos de artrite reumatoide, uma doença autoimune que gera um processo inflamatório autoperpetuado. No Brasil, este biofármaco vem sendo utilizado principalmente em tratamento para psoríase crônica e artrite reumatóide em adultos e crianças, estando presente na Relação Nacional de Medicamentos Essenciais de 2022 (Rename), instrumento utilizado pelo Sistema Único de Saúde (SUS) para controle de patologias no Brasil.
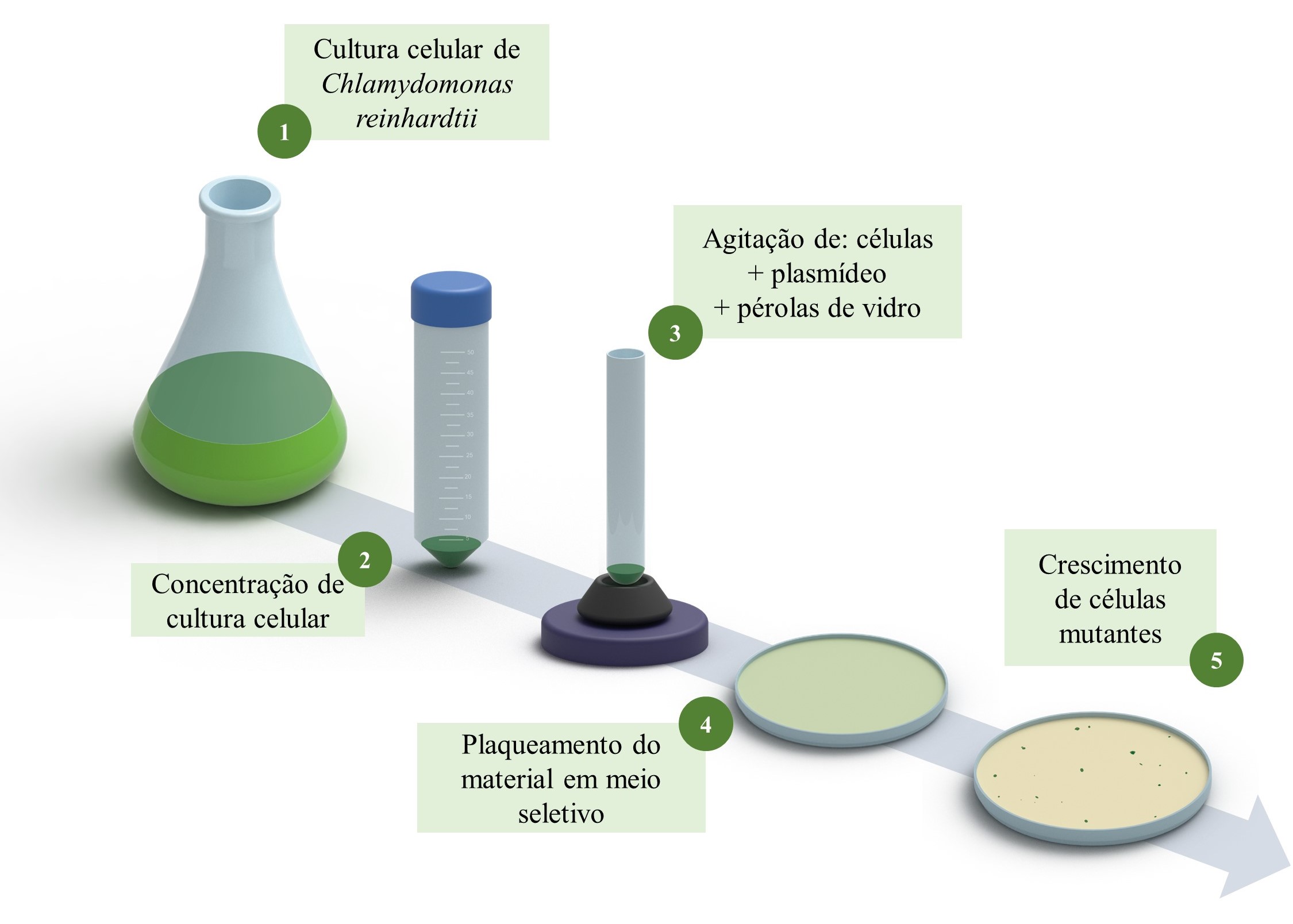
Figura 3. Metodologia de transformação da microalga por pérolas de vidro.
Foram construídos plasmídeos de DNA, os quais são DNAs circulares que servem como carregadores do material genético para dentro da célula alvo, e que foram desenhados para que ocorra a integração do gene de interesse no genoma do cloroplasto da microalga. A técnica utilizada para que o plasmídeo de DNA entre nas células, e atinja o alvo genético, foi a metodologia de pérolas de vidro. Um método barato onde a cultura de microalga concentrada é agitada na presença de pérolas de vidro e o plasmídeo de DNA 4. Assim, é esperado que através da ação abrasiva seja possível a entrada do material de interesse (figura 3). Após o processo, o material celular é adicionado em um meio seletivo, onde apenas os organismos modificados geneticamente irão crescer, seguindo etapas de análise gênica e de síntese proteica.
Foram obtidos mutantes da microalga tanto para a síntese da cadeia leve, quanto para a síntese da cadeia pesada, regulados em nível de expressão pelos promotores fotossintéticos psbD e psbA (figura 4). Os resultados indicam compatibilidade da expressão e síntese recombinantes no cloroplasto de ambas as cadeias do anticorpo Adalimumabe, havendo a dimerização das cadeias pesadas do anticorpo, um indicativo da interação entre essas cadeias para a formação da estrutura polipeptídica complexa requerida. Outro dado importante na síntese recombinante, de ambas as cadeias isoladamente, foi a não observação de formação de agregados proteicos. Os agregados proteicos representam diferentes unidades da proteína recombinante interagindo fortemente entre si, podendo ser decorrente de diferentes fatores, mas em destaque pela conformação proteica inadequada, com exposição de regiões hidrofóbicas. A ocorrência destes corpos de aglomeração proteica impactaria na montagem do anticorpo e consequentemente na eficiência da plataforma de expressão.
Contudo, para que seja possível a síntese completa do anticorpo na microalga, ambas as cadeias necessitam ser sintetizadas simultaneamente dentro de um mesmo organismo, sendo necessária a aplicação de uma cotransformação. Neste caso, aplicamos uma cotransformação genética, que é o processo de repetição da transformação gênica utilizando um outro vetor plasmidial e a técnica de pérola de vidro. A cotransformação foi realizada em uma cepa mutante capaz de sintetizar a cadeia leve do anticorpo, utilizando um segundo vetor de expressão de cadeia pesada. De 12 colônias cotransformadas, resistentes ao antibiótico de seleção, escolhidas de modo aleatório, oito apresentaram amplificação genômica de cadeia pesada e leve simultaneamente. Este resultado, indica que houve integração da sequência gênica de ambas as cadeias do anticorpo monoclonal Adalimumabe no genoma do cloroplasto de C. reinhardtii.
Atualmente, o grupo de pesquisa está trabalhando na detecção do produto recombinante produzido por este mutante cotransformado, sendo promissoras as perspectivas de síntese do anticorpo completo nas próximas etapas. Considerando estes e outros mutantes obtidos, a expressão e síntese no cloroplasto da microalga C. reinhardtii se mostrou bastante estável. Entretanto, verificamos que proteínas maiores tendem a ter níveis de síntese reduzido, quando comparado a proteínas menores. Para a síntese de um anticorpo completo é necessário otimizar os processos de forma que esta síntese ocorra em níveis estequiométricos equivalentes entre cadeia leve e pesada. Com este trabalho, será possível produzir uma nova proteína recombinante complexa, o medicamento biológico Adalimumabe, capaz de ser sintetizado por esta plataforma alternativa que é a microalga Chlamydomonas reinhardtii. É importante ressaltar que ainda há um longo caminho de análise destes produtos recombinantes para que sejam aplicados em sua devida finalidade. Por fim, a descrição de múltipla expressão gênica recombinante, utilizando metodologias de baixo custo, e a síntese de proteínas cada vez mais complexas, aprimora o repertório para a modificação genética deste organismo e corrobora com a exposição de seu potencial biotecnológico.

Figura 4. Cultura celular de cepas selvagem e mutantes em meio de cultivo líquido (a) e sólido (b).
Referências:
Arias, C. A. D. et al. Production of Recombinant Biopharmaceuticals in Chlamydomonas reinhardtii. International Journal of Plant Biology 14, 39–52 (2022).
Mayfield, S. P.; Franklin, S. E.; Lerner, R. A. Expression and assembly of a fully active antibody in algae. Proceedings of the National Academy of Sciences of the United States of America, v. 100, n. 2, p. 438–442, 21 jan. 2003.
3. Tran, M., Zhou, B., Pettersson, P. L., Gonzalez, M. J. & Mayfield, S. P. Synthesis and assembly of a full-length human monoclonal antibody in algal chloroplasts. Biotechnol Bioeng 104, 663–673 (2009).
4. Cutolo, E. A., Mandalà, G., Dall’osto, L. & Bassi, R. Harnessing the Algal Chloroplast for Heterologous Protein Production. Microorganisms 2022, Vol. 10, Page 743 10, 743 (2022).



Redes Sociais