Influência de espécies reativas de oxigênio na atividade epileptiforme em camundongos
 Glenda Sinara Teodoro de Lima [a], Cayo Antônio Soares de Almeida [b], Renan Paschoalino Pongilio [b], Luciana Simões Rafagnin Marinho [c], Alexandre Hiroaki Kihara [d]*
Glenda Sinara Teodoro de Lima [a], Cayo Antônio Soares de Almeida [b], Renan Paschoalino Pongilio [b], Luciana Simões Rafagnin Marinho [c], Alexandre Hiroaki Kihara [d]*
[a] Discente de graduação do curso de graduação “Bacharelado em Ciência e Tecnologia (BC&T)” da Universidade Federal do ABC (UFABC)
[b] Discente do programa “Pós-graduação em Neurociência e Cognição” da Universidade Federal do ABC
[c] Pesquisadora colaboradora da Universidade Federal do ABC
[d] Docente da Universidade Federal do ABC
*Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo. - https://orcid.org/0000-0002-4027-7261
Resumo: Este estudo tem como objetivo caracterizar o perfil das crises epilépticas em diferentes linhagens de camundongos, com foco na relação entre epilepsia, neuroinflamação e espécies reativas de oxigênio (EROs), especialmente na epilepsia do lobo temporal (ELT), a forma mais comum da doença e que representa um desafio terapêutico devido à significativa parcela de pacientes refratários aos tratamentos disponíveis. Pesquisas anteriores evidenciaram uma correlação entre níveis elevados de EROs e a gravidade de crises na ELT, destacando a influência da neuroinflamação e do sistema enzimático NOX2. Em nosso estudo foi observado que camundongos knockout para o complexo enzimático NOX2 apresentaram redução nas crises epilépticas de alta intensidade e menor mortalidade, sugerindo um potencial terapêutico focado na regulação dos níveis de EROs. Estes resultados reforçam a importância de investigações adicionais direcionados ao desenvolvimento de tratamentos específicos para ELT, o que poderia abrir caminho para abordagens terapêuticas inovadoras e mais eficazes.
Palavras-chave: Epilepsia; NOX2; PTZ; status epilepticus.
Abstract: This study aims to characterize the profile of epileptic seizures in different strains of mice, focusing on the relationship between epilepsy, neuroinflammation, and reactive oxygen species (ROS), especially in temporal lobe epilepsy (TLE), the most common form of the disease and a therapeutic challenge due to a significant portion of patients refractory to available treatments. Previous research has shown a correlation between elevated levels of ROS and the severity of seizures in TLE, highlighting the influence of neuroinflammation and the NOX2 enzymatic system. In our study, it was observed that NOX2 knockout mice exhibited reduced high-intensity epileptic seizures and lower mortality, suggesting a therapeutic potential focused on regulating ROS levels. These results reinforce the importance of additional investigations aimed at developing specific treatments for TLE, which could pave the way for innovative and more effective therapeutic approaches.
Keywords: Epilepsy; NOX2; PTZ; status epilepticus.
Epilepsia
A epilepsia é uma condição neurológica caracterizada por alterações encefálicas que promovem modulações no funcionamento cerebral de maneira contínua. Há inúmeras causas para a epilepsia, dentre elas, lesões cerebrais, anomalias genéticas, infecções, distúrbios metabólicos e, em alguns casos, a causa é desconhecida. De acordo com a Organização Mundial de Saúde, a epilepsia atinge cerca de 50 milhões de pessoas no mundo, com maior prevalência em países de baixa e média renda. Essa condição está associada ao acesso limitado a cuidados de saúde, falta de diagnóstico adequado ou tratamento e condições socioeconômicas desfavoráveis. Além disso, maior incidência de fatores de risco, como trauma craniano em decorrência de acidentes ou violência, infecções neonatais, como meningite ou encefalite, ou ainda complicações durante o parto, assim como desnutrição e infecções parasitárias, por exemplo, presença de cisticerco da Taenia solium, podem ser fatores importantes para aquisição e estabelecimento de epilepsia. É importante ressaltar que a epilepsia é uma condição neurológica global e pode afetar pessoas em todos os países, independentemente do desenvolvimento regional. No entanto, os desafios adicionais enfrentados por países subdesenvolvidos podem resultar em uma maior incidência de epilepsia.
Dentre as diversas formas de epilepsia, a Epilepsia do Lobo Temporal (ELT) é a mais comum, constituindo até 60 % dos casos, nos quais de 30% a 40% dos pacientes não respondem aos tratamentos medicamentosos disponíveis. Diante disso, é importante investigar os mecanismos fisiopatológicos da doença para desenvolvimento de novas abordagens terapêuticas.
As alterações encefálicas que ocorrem no quadro de ELT resultam de descargas anormais e excessivas de atividade elétrica no cérebro, denominada crise epiléptica. As crises epilépticas, podem apresentar manifestações motoras involuntárias, comportamentais e alterações na consciência. Quando relacionado ao quadro de epilepsia, as crises epilépticas não estão associadas a causas secundárias, entretanto, é possível a ocorrência de um evento pontual dessa atividade cerebral irregular por inúmeras outras causas como presença de febre, uso de drogas ou presença de distúrbios metabólicos.
As crises epilépticas podem variar em intensidade e tipo de manifestação, desde episódios breves restritos ao local onde iniciaram, chamadas de crises focais e crises generalizadas ou bilaterais que afetam os dois hemisférios cerebrais. O tratamento, redução ou bloqueio de crises epilépticas, geralmente, envolve medicamentos anti-crise, embora em alguns casos possa ser necessária cirurgia ou outras terapias adicionais como aquelas baseadas em dietas. É importante ressaltar que não há tratamentos com efeitos antiepilépticos, ou seja, terapias efetivas capazes de eliminar a epilepsia. Por isso, tratamentos anti-crise atenuam um dos principais sintomas da doença, melhorando a qualidade de vida do paciente, porém não há, até o momento, possibilidade de cura da epilepsia.
Diante disso, observa-se na literatura diversos mecanismos relacionados à fisiopatologia da ELT, dos quais a neuroinflamação e espécies reativas de oxigênio (EROs) estão intimamente relacionadas às modulações encefálicas para o desencadeamento e manutenção de crises epilépticas, além de contribuírem para o desenvolvimento e estabelecimento da doença, no que consiste em um evento denominado epileptogênese. Nessa mesma perspectiva, a neuroinflamação refere-se à ativação de células do sistema imunológico no cérebro, como astrócitos e micróglia. Essas células produzem mediadores inflamatórios, por exemplo, citocinas que são liberadas em resposta a danos, infecções ou outros estímulos. Esse mecanismo neuroinflamatório somado à liberação excessiva de EROs podem desempenhar um papel importante na geração e propagação de eventos epileptiformes, consequentemente, promovendo gliose reativa e morte neuronal (Figura 1).
Neste mesmo contexto, as EROs, produzidas naturalmente durante o metabolismo celular, são moléculas altamente reativas contendo oxigênio, que em condições patológicas, como na neuroinflamação, são produzidas de forma exacerbada. Na epilepsia, a neuroinflamação e o aumento das EROs podem desencadear uma cascata de eventos que contribuem para a hiperexcitabilidade neuronal, morte celular e, consequentemente, progressão da doença. Por exemplo, as EROs podem causar danos diretos aos neurônios, levando à disfunção sináptica e à morte celular. Além disso, a neuroinflamação pode aumentar a excitabilidade neuronal e reduzir a eficácia dos mecanismos de regulação neuronal, tornando o cérebro mais propenso a crises epilépticas.
Assim sendo, a principal fonte de EROs no cérebro consiste em um sistema enzimático conhecido como NADPH oxidase (NOX). Este sistema é composto por várias isoformas de enzimas, sendo a NOX2 uma das mais abundantes no cérebro. As células gliais, especialmente, micróglias, são as principais células do sistema nervoso central que expressam a NOX2 e estão envolvidas na geração de EROs durante a resposta imune e em condições patológicas, como a neuroinflamação e a epilepsia. Além disso, outras fontes de EROs no cérebro incluem a atividade mitocondrial, a oxidação lipídica e a ativação de células imunes infiltrantes. No entanto, a NOX2 é considerada uma das principais fontes de EROs no contexto da epilepsia e de outras condições neurológicas. Portanto, a correlação entre a fisiopatologia da epilepsia, neuroinflamação e EROs se destaca como pontos-chance para o entendimento da doença e, consequentemente, para as possibilidades de desenvolver novas abordagens terapêuticas.
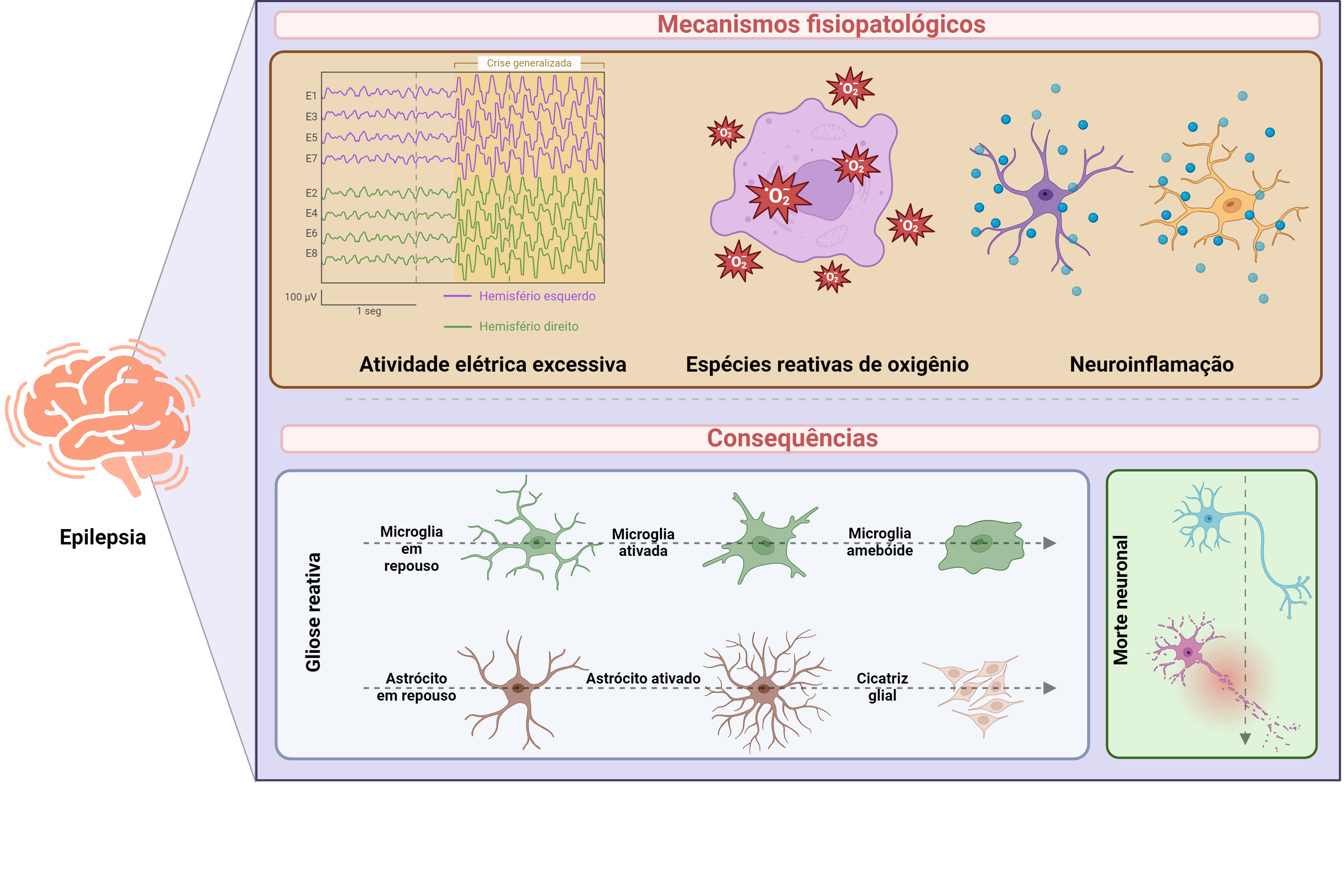
Figura 1: Fisiopatologia e consequências da epilepsia. Cérebro com epilepsia adquirida apresenta alta atividade elétrica, produção excessiva de EROs e ativação glial promovendo liberação de fatores neuroinflamatórios, como demonstrado na parte superior da figura. Na parte inferior da figura é demonstrado as principais consequências da epilepsia que consiste em gliose reativa, a partir da ativação de astrócitos e microglias, resultando em alterações na morfologia e fisiologia celular, além de consequências neurodegenerativas, como morte neuronal. Ilustração desenvolvida no Biorender, 2024.
Nosso estudo
Para o verificar a potencial contribuição do complexo enzimático NOX2, nós utilizamos o modelo de crises epilépticas induzidas por pentilenotetrazol (PTZ). Esse modelo é uma ferramenta bem estabelecida na literatura para estudos ou testes terapêuticos devido à sua capacidade de induzir crises de intensidade variável em biomodelos (Figura 2). O PTZ age principalmente inibindo a ação do neurotransmissor ácido gama-aminobutírico (GABA) no cérebro. O GABA desempenha um papel crucial na regulação da excitabilidade neuronal, agindo como um neurotransmissor inibitório. Quando o PTZ bloqueia os receptores GABAA, que são os principais receptores inibitórios mediados pelo GABA, reduz a capacidade de inibição geral no cérebro, consequentemente, exacerbando excitabilidade neuronal. Em termos práticos, significa que os neurônios têm uma maior probabilidade de gerar potenciais de ação e de se tornarem hiperativos. Como resultado, ocorrem crises epilépticas devido à hiperexcitação generalizada do sistema nervoso central. O modelo de PTZ é valioso porque permite estudar os mecanismos subjacentes às crises, bem como avaliar a eficácia de potenciais tratamentos anti-crise e, possivelmente, anti-epiléptico em biomodelos.
Para melhor entendimento da contribuição de uma estrutura biológica para a fisiopatologia de uma doença, comumente, são utilizados animais com alterações genéticas em estudos científicos. Esses animais são capazes de ajudar a elucidar interações biológicas no modelo de doença humana. Dessa maneira, um animal knockout é um organismo geneticamente modificado, geralmente um camundongo, no qual um ou mais genes específicos são inativados ou nocauteados, por isso o termo knockout. Esse procedimento ocorre através de técnicas de engenharia genética. A CRISPR/Cas9 ou tecnologia de recombinação homóloga, por exemplo, refere-se a uma ferramenta de edição genética que permite modificar o DNA de maneira precisa por utilizar uma RNA guia com o objetivo de identificar a sequência-alvo no DNA e a enzima Cas9 para cortar essa sequência de interesse. Após o corte, a célula repara o DNA, permitindo a inserção, deleção ou substituição de genes. No caso de inativação resulta na ausência funcional de um gene alvo no organismo. Em nosso laboratório, os camundongos utilizados para esse estudo são knockout para o gene gp91phox-, crucial para ativação do complexo enzimático NOX2.
Aliado ao conhecimento sobre o complexo NOX2, liberação de EROs em ambiente favorável e crises epilépticas, hipotetizamos que redução na produção de EROs, devido a inibição de NOX2, possa reduzir a geração e propagação de eventos epileptiformes. Para investigar tal possibilidade, utilizamos camundongos knockout (NOX2 KO) para caracterizar o perfil de crise epiléptica em comparação à animais Wild Type (WT) sem mutação genética.
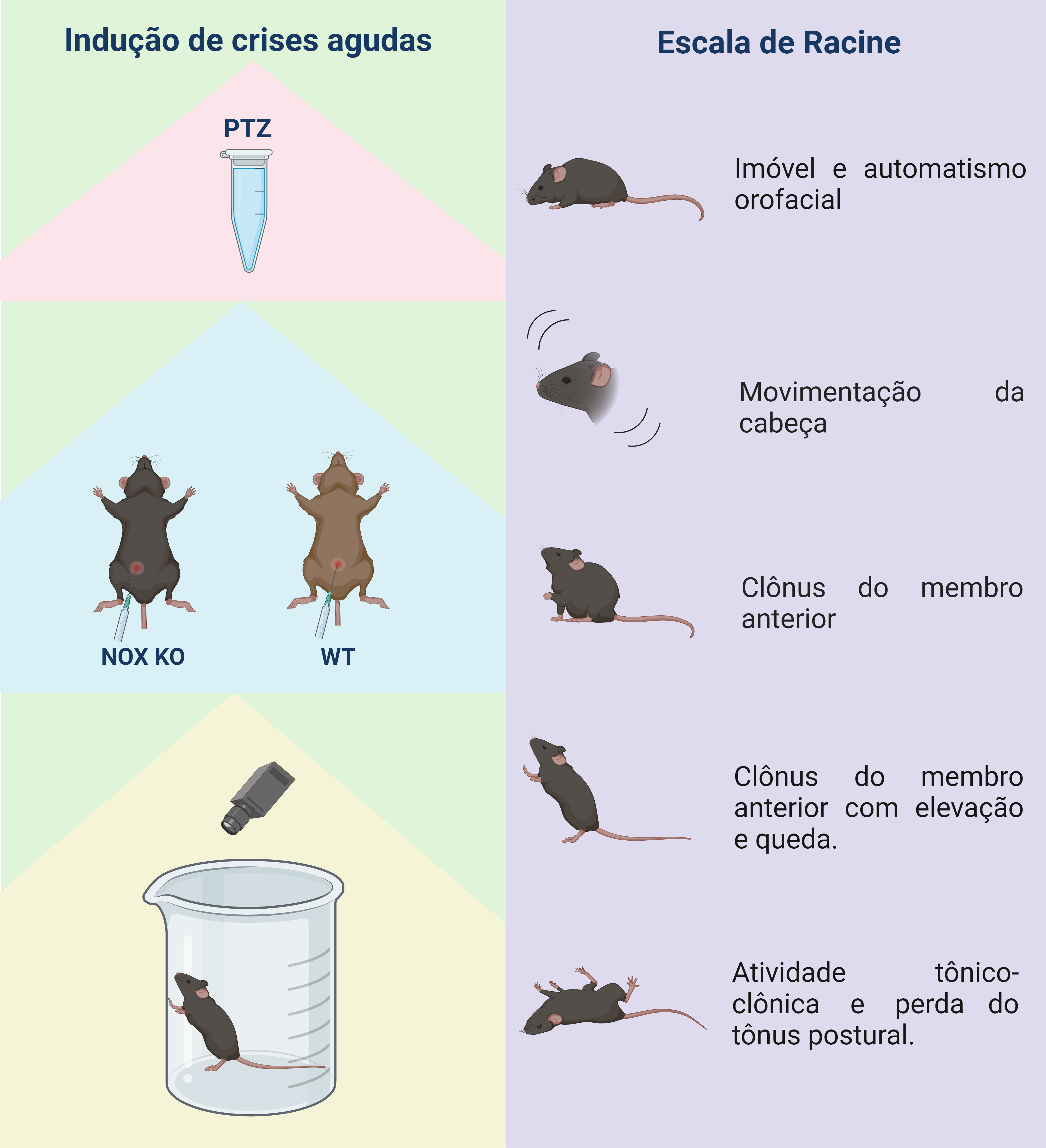
Figura 2: Modelo esquemático de crises epilépticas agudas. O lado esquerdo da figura demonstra indução de crises epilépticas agudas por PTZ a partir da aplicação intraperitoneal em animais NOX2 KO e WT. A sensibilidade dos animais foi acompanhada e registrada por 30 minutos. O lado direito da figura demonstra o estado comportamental apresentado pelos animais baseado na escala de Racine. Ilustração desenvolvida no Biorender, 2024.
Para a análise das crises epilépticas, alguns parâmetros foram considerados em todos os animais, incluindo a incidência de crises de alta intensidade e taxa de mortalidade. Para a classificação do tipo de crise baseamos na escala de Racine (representada pela classificação 1 a 5). A escala de Racine é bem estabelecida na literatura e descreve características comportamentais observadas em camundongos durante as crises, desde sua apresentação mais atenuada (representada pela classificação 1) até a mais grave (representada pela classificação 5).
Após a indução das crises epilépticas com PTZ, os dados indicaram redução do número de crises do tipo 5 em camundongos NOX2 KO (WT: 4,222 ± 0,4339 e NOX2 KO: 1,786 ± 0,2386), além disso, a taxa de mortalidade foi calculada em porcentagem dividindo o número de animais que morreram pelo número total de animais, assim, nossos dados demonstraram maior mortalidade em animais WT com demonstrado pela barra preta. (WT: 72,73% e NOX2 KO: 46,67).
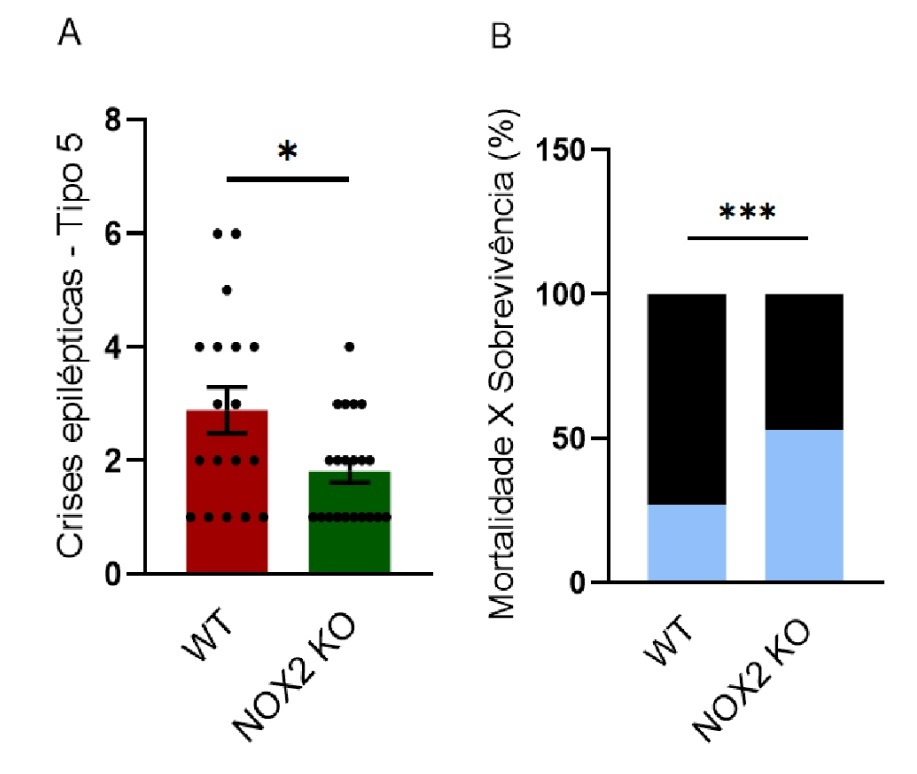
Figura 3. Susceptibilidade de camundongos à crises epilépticas induzidas por PTZ . (A) Número de crises tipo 5 em animais WT representados pela barra vermelha e NOX2 KO representado pela barra verde. (B) Porcentagens de sobrevivência (azul) versus mortalidade (preto). As barras representam erros padrão das médias. *P<0,005, ***P<0,001. Dados analisados utilizando o Teste t de Student e Chi-quadrado no software Prism GraphPad.
Considerações finais
A análise das crises após a injeção de PTZ revelou resultados significativos, indicando uma relação entre os níveis reduzidos de espécies reativas de oxigênio (EROs), decorrentes da deleção genética em animais knockout e menor número de crises epilépticas graves ou do tipo 5. Essa correlação destaca a importância de investigações adicionais para compreender melhor os mecanismos subjacentes à epilepsia e desenvolver abordagens terapêuticas mais eficazes. Terapias direcionadas ao complexo enzimático NOX2 emergem como uma estratégia promissora para minimizar os efeitos secundários da lesão inicial, como a neuroinflamação. A regulação e o controle da expressão e atividade do NOX2 podem representar uma potencial abordagem terapêutica para prevenir a epilepsia, especialmente em pacientes que não respondem às terapias convencionais. Assim, a compreensão do papel das EROs e da neuroinflamação na epilepsia abre caminho para novas perspectivas no desenvolvimento de tratamentos mais direcionados e específicos, com o potencial de melhora da qualidade de vida dos pacientes afetados por essa condição.
Os resultados deste estudo têm implicações consideráveis para o desenvolvimento de novas terapias voltadas ao tratamento da epilepsia, especialmente em relação à modulação das EROs e da neuroinflamação. A redução na gravidade das crises epilépticas tipo 5 em camundongos NOX2 KO, juntamente com a diminuição da taxa de mortalidade, sugere que o complexo enzimático NOX2 desempenha um papel central na mediação da resposta epileptiforme. No ponto de vista clínico, pode beneficiar pacientes que não respondem adequadamente às terapias atualmente disponíveis.
O fato de camundongos com o complexo NOX2 inativos apresentarem crises menos intensas e menor mortalidade indica que a produção de EROs, mediada por NOX2, está diretamente ligada à severidade das crises epilépticas e à progressão da doença. Assim, terapias que visem a inibição de NOX2, ou a redução da produção de EROs, poderiam atenuar a gravidade das crises e reduzir os danos neuroinflamatórios subsequentes, que frequentemente pioram o quadro de epilepsia. A possibilidade de interferir nesse ciclo patológico pode não apenas prevenir o agravamento das crises, mas também reduzir o risco de danos neurológicos permanentes, consequentemente, melhorando a qualidade de vida dos pacientes.
Além disso, a regulação da expressão e atividade de NOX2 poderia oferecer uma abordagem personalizada para o tratamento da epilepsia, adaptando-se a diferentes subtipos da doença e às características individuais dos pacientes. Em última análise, a exploração de terapias baseadas na modulação de EROs e NOX2 pode abrir novas frentes no tratamento da epilepsia, trazendo esperança para aqueles afetados por essa condição neurológica crônica e debilitante.
Agradecimentos
Este trabalho contou com o apoio financeiro da FAPESP, CAPES, CNPq.
Referências
1. Almeida et al. Distinct cell-specific roles of NOX2 and MyD88 in Epileptogenesis. Frontiers in cell and developmental biology, Volume 10, 926776, 2022.
2. Royero et al. Ryanodine receptors drive neuronal loss and regulate synaptic proteins during epileptogenesis. Experimental Neurology, Volume 327, 113213, 2020.
3. Kinjo et al. Reciprocal Regulation of Epileptiform Neuronal Oscillations and Electrical Synapses in the Rat Hippocampus. Plos One, Volume 9, 109149, 2022.
4. Taupin, Philippe. The Hippocampus: Neurotransmission and Plasticity in the Nervous System. Nova Science Publishers, New York, EUA, 2007.
5. Zamanian et al. Genomic analysis of reactive astrogliosis. J Neurosci 32(18): 6391-6410, 2012.
6. Yuskaitis et al. Factors influencing the acute pentylenetetrazole-induced seizure paradigm and a literature review. Ann Clin Transl Neurol 8(7): 1388-1397, 2021.

Redes Sociais