Propagação dos Mecanismos Fibrilatórios da Fibrilação Atrial nas Superfícies 3D dos Atrios: Um Estudo Computacional

A Revista Eletrônica PesquisABC possui o seguinte registro ISSN: 2675-1461
Felipe Braga Fonseca, Italo Sandoval, João Lameu, João Salinet*.
HeartLab, Universidade Federal do ABC
Resumo: A fibrilação atrial (FA) é a arritmia cardíaca sustentada mais comum na prática clínica, com impacto significativo na qualidade de vida dos pacientes. A pesquisa clínica avançou significativamente no entendimento dos mecanismos que desencadeiam e mantêm a FA. Com esse progresso, as simulações em eletrofisiologia cardíaca emergiram como uma ferramenta de destaque na investigação básica em cardiologia. Assim, o objetivo deste estudo é simular os principais mecanismos de FA (focos ectópicos, rotores e reentradas múltiplas) em uma superfície 3D do átrio direito. Foi utilizado o openCARP, com o modelo matemático Courtemanche para células atriais e o modelo monodomínio para representar a comunicação entre células miocárdicas em atividade elétrica. As simulações foram classificadas visualmente utilizando o Meshalyzer, integrante do openCARP. Além disso, foram realizadas análises qualitativas, incluindo observações da morfologia da frente de onda, condições iniciais que geram o mecanismo, formato do sinal do potencial transmembrana e padrões em regiões fibróticas. Em resumo, estas simulações evidenciam a viabilidade e potencial do estudo computacional em eletrofisiologia cardíaca. Ademais, apoiam as teorias dos mecanismos simulados da FA e podem revelar padrões subjacentes de condições arrítmicas, fornecendo insights para a compreensão desta doença, com potenciais aplicações na prática clínica e futuros estudos in silico.
Palavras-chave: fibrilação Atrial; simulações computacionais; mecanismos da fibrilação atrial; modelos matemáticos de células cardíacas.
Abstract: Atrial fibrillation (AF) is the most common sustained cardiac arrhythmia in clinical practice, with a significant impact on patients' quality of life. Clinical research has advanced significantly in understanding the mechanisms that trigger and maintain AF. With this progress, simulations in cardiac electrophysiology have emerged as a prominent tool in basic cardiology research. Thus, the aim of this study is to simulate the main mechanisms of AF (ectopic foci, rotors, and multiple reentries) on a 3D surface of the right atrium. OpenCARP was used, with the Courtemanche mathematical model for atrial cells and the monodomain model to represent the communication between myocardial cells in electrical activity. The simulations were visually classified using Meshalyzer. In addition, qualitative analyses were performed, including observations of wavefront morphology, initial conditions that generate the mechanism, signal shape of the transmembrane potential, and patterns in fibrotic regions. In summary, these simulations show the feasibility and potential of computational study in cardiac electrophysiology. In addition, they support theories of simulated mechanisms of AF and can reveal underlying patterns of arrhythmic conditions, providing insights for the understanding of this disease, with potential applications in clinical practice and future in silico studies.
Keywords: atrial fibrillation; computer simulations; mechanisms of atrial fibrillation; mathematical models of cardiac cells.
ORCID: 0000-0003-2906-9397
Contextualizando o Problema da Arritmia Cardíaca mais Frequente no Mundo
A fibrilação atrial (FA) é a arritmia cardíaca mais comum encontrada na prática clínica, afetando cerca de 1% da população mundial [1]. A incidência aumenta conforme a idade, chegando a 9% para octogenários, e geralmente está associada a doenças estruturais cardíacas, trazendo prejuízos hemodinâmicos e complicações tromboembólicas com grandes implicações econômicas [2]. Estima-se que a FA seja responsável por 33% de todas as internações por arritmia [3-5]. Esse distúrbio tem alta morbidade e mortalidade [6], e tornou-se uma epidemia cardiovascular não infecciosa crônica com grande consumo de recursos em saúde [7].
A FA se caracteriza pelo colapso da atividade elétrica cardíaca organizada – responsável pelo bombeamento periódico e sincronizado dos átrios – para padrões de ativação elétricos desorganizados e autossustentáveis, com consequente deterioração de sua função mecânica, condição decorrente de causas múltiplas e pode ocorrer em pacientes jovens sem cardiopatia estrutural demonstrável [1]. Tais ativações competem com aquelas geradas naturalmente no nó sinoatrial, responsáveis pelo ritmo regular (sinusal) do coração; a sobreposição destes fenômenos aumenta a complexidade da FA e a frequência de ativação em certas áreas dos átrios em até 500 vezes por minuto [8].
Um dos grandes riscos da arritmia decorre do esvaziamento parcial dos átrios devido às contrações assíncronas, o que favorece a formação de coágulos. Esses coágulos são geralmente deslocados para a circulação sanguínea e causam episódios de tromboembolia (i.e. bloqueio de artérias) e há, consequentemente, um aumento no risco de ocorrência de acidentes vasculares cerebrais isquêmicos, em até cinco vezes [9], insuficiência cardíaca e morte súbita [10].
Os sintomas e morbidades da FA são responsáveis por frequentes visitas a centros de saúde e levam a substanciais e crescentes custos [1], tornando-se assim um problema tanto de qualidade de vida do paciente, quanto de saúde pública. Atualmente, três mecanismos principais são responsáveis pelo desencadeamento e manutenção da FA: atividade focal, rotor e múltiplas reentradas intra-atriais contínuas [1].
Nas últimas décadas, a pesquisa básica e clínica, juntamente com o estudo através de modelos matemáticos da eletrofisiologia cardíaca, permitiram grandes avanços na melhoria do diagnóstico e tratamento de diversas arritmias, mesmo complexas, como é o caso da FA, tendo seu mecanismo gradativamente elucidado, mas não totalmente esclarecido. Modelos computacionais de átrios fornecem informações complementares àquelas obtidas com estudos eletrofisiológicos, ajudando a entender os padrões de excitação tanto em corações saudáveis quanto arrítmicos, incluindo os principais mecanismos da FA, integrando os achados com os obtidos em modelos animais e humanos [11,12]. Esses modelos podem ser usados para entender os mecanismos arrítmicos, validar terapias, testar os resultados das intervenções e para a customização de tratamentos [12,13].
Os modelos computacionais tem conseguido simular representações dos padrões arrítmicos, incluíndo características da remodelação atrial, observados nos pacientes, como a presença de tecido fibrótico, que está fortemente relacionada à FA. No entanto, muito progresso na compreensão das arritmias t&em sido obtido com a ajuda de modelos computacionais. Assim, este estudo tem como objetivo contribuir com as simulações sobre os mecanismos da FA, atividade focal, rotor e múltiplas reentradas intra-atriais contínuas em uma superfície epicárdica tridimensional (3D) do átrio direito.
As etapas necessárias para simular os mecanismos da FA
As simulações dos mecanismos da FA foram realizadas usando o software openCARP, uma plataforma de simulação de código aberto. Ele é equipado com a estrutura carputils, que permite configurar os parâmetros fisiológicos da simulação usando a linguagem de programação Python, compreendendo a fisiologia do problema sem a necessidade de conhecer a fundo os detalhes numéricos subjacentes aos processos [14]. Além disso, para visualizar e analisar os dados obtidos após as simulações, a ferramenta Meshalyzer, também parte do openCARP, foi usada. Os mecanismos foram simulados em uma superfície epicárdica 3D do átrio direito composta por 64.266 vértices e 127.905 triângulos15 a partir de dados de ressonância magnética de tensor de difusão ex vivo de alta resolução.
Para realizar as simulações de maneira computacional, foi necessário representar matematicamente as células atriais, portanto, para isso, o modelo matemático de Courtemanche16 foi utilizado como representação da célula. Eles desenvolveram um modelo matemático baseado em dados registrados de miócitos atriais humanos para descrever as correntes iônicas que ocorrem durante PA nas células cardíacas. Neste modelo, a membrana celular é representada como um capacitor que acumula cargas, conectado em paralelo com resistores e baterias, onde os canais iônicos atuam como resistores e as baterias como forças motrizes.
A derivada do potencial elétrico da membrana (V) em relação ao tempo (t) é expressa pela equação (1):
dVdt=-(Iion +Ist)Cm dVdt=-(Iion +Ist)Cm dVdt=-(Iion +Ist)Cm (1)
Onde Ist é a corrente de estímulo que flui através da membrana, Iion é dada pela soma das principais correntes (Eq. 2), com cada uma tendo seu canal iônico específico e Cm é a capacitância da membrana, valor constante de 100 pF16:
Iion=INa+IK1+Ito+IKur+IKr+IKs+ICa,L+Ip,Ca+INaK+INaCa+Ib,Na+Ib,Ca (2)
Adicionalmente, em algumas simulações, foi aplicada uma variante do modelo de Courtemanche para representar o remodelamento elétrico causado pela FA crônica, desenvolvido por Loewe et al.17. Uma das diferenças significativas entre esta variante e o modelo original de Courtemanche é o período refratário, pois o modelo original possui um período refratário consideravelmente mais longo, não favorecendo simulações dos mecanismos de FA. A Figura 1A ilustra o PA de uma única célula simulada com o modelo Courtemanche, e a Figura 1B ilustra o PA da variante de Loewe.
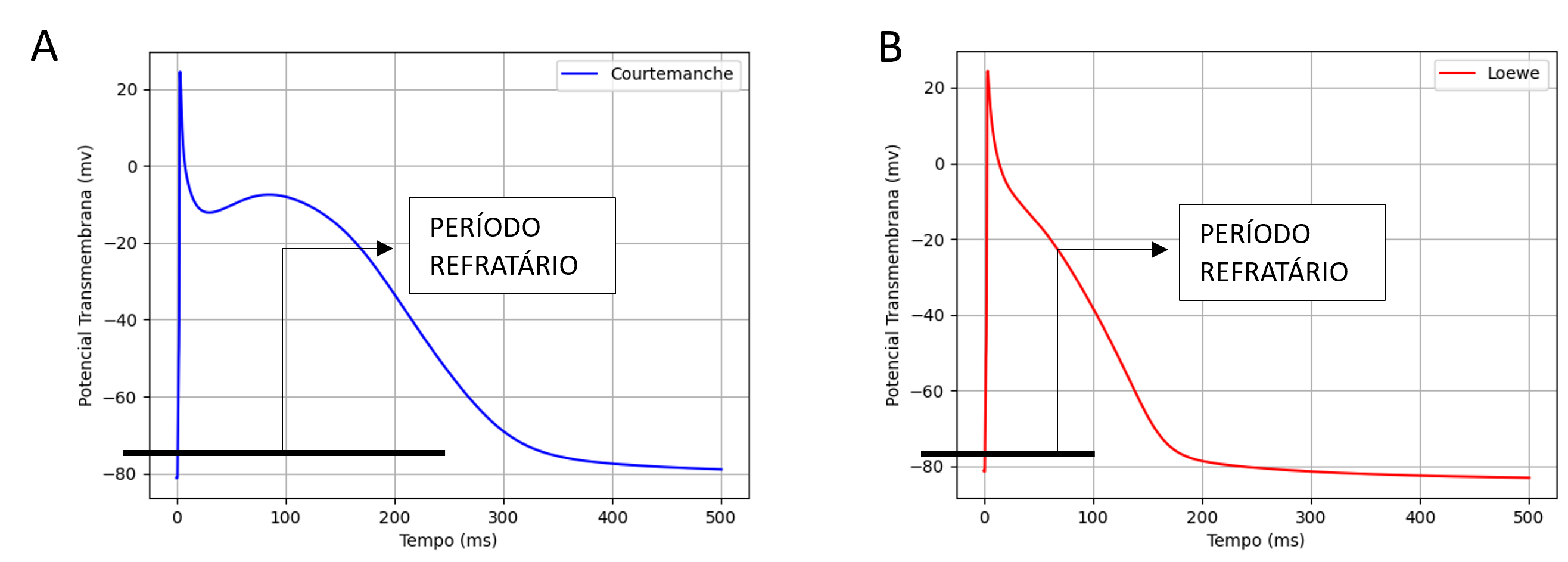
Figura 1: Curva do PA para uma célula modelada através de Courtemanche (A) e variante Loewe (B). A partir desta figura é possível observar que o período refratário é menor para esta variante em comparação ao modelo original de Courtemanche.
A análise das células como unidades separadas com o modelo Courtemanche permite que elas sejam acopladas para representar a comunicação elétrica entre as células miocárdicas18. Desse modo, a abordagem matemática utilizada nas simulações para conectar as células cardíacas e propagar o PA no tecido foi o modelo monodomínio (Eq. 3):
XCm∂V∂t+IionV,= V (3)
Onde V é a variável de interesse, representando o potencial transmembrana, é o tensor de condutividade que descreve as propriedades elétricas do tecido, X é a relação superfície-volume das células cardíacas, Cm é a capacitância da membrana, Iion é a densidade total de corrente iônica, que é uma função de V e um vetor de variáveis de estado , descrito por um sistema de equações diferenciais para controlar a cinética das variáveis de estado dos canais iônicos, que alternam entre estados abertos e fechados dependendo do potencial, tempo, ou concentrações de íons18.
- Simulação do Mecanismo Onda Planar
Para simular propagações do PA em ritmo sinusal, foi desenvolvida uma simulação de onda planar (PWS). Nesta simulação, um estímulo com densidade de corrente de 250 µA/cm2 foi aplicado na região do nó sinusal por 2 ms, na frequência de 1,5 Hz. Duração da simulação: 3000 ms, a condutividade intracelular nas direções longitudinal (gil) e transversal (git) das fibras foi ajustada para 0,174 S/m. No domínio extracelular, as condutividades longitudinais (gel) e transversal (get) do foram ajustadas para 0,625 S/m.
- Simulações do Mecanismo da FA: Focos Ectópicos
Para os focos ectópicos foram realizadas duas simulações, uma com um único foco (EF1) e outra com três focos (EF2). A condutividade do tecido foi ajustada para 0,174 S/m para gil e git e 0,625 S/m para gel e get. O protocolo de estimulação tecidual foi definido inserindo a estimulação do nó sinusal e disparo(s) adicional(is) representando o(s) foco(s) ectópico(s), localizado(s) próximo(s) à crista terminal, com densidade de corrente de 250 µA/cm2, frequência de 7 Hz e duração de 2 ms. O tempo das simulações EF1 e EF2 foi de 5.000 ms.
- Simulações do Mecanismo da FA: Rotor
Um total de seis simulações de rotor foram realizadas. Duas delas foram realizadas utilizando o seguinte método: uma nova região próxima à crista terminal foi criada na malha. Nessa região, o modelo de Loewe foi aplicado para representar o remodelamento elétrico causado pela FA crônica. Nesta região atrial, os valores de condutividade também foram diminuídos, sendo gil e git iguais a 0,08 S/m e gel e get iguais a 0,521 S/m, deixando o tecido com maior incidência de anisotropia, o que favorece a ocorrência de circuitos reentrantes. O estímulo sinusal manteve suas configurações e um estímulo ectópico foi inserido na região da crista terminal, com frequência de 10 Hz, densidade de corrente de 250 µA/cm2 e duração de 2 ms. Foram realizadas duas variações desta simulação, alterando ligeiramente a localização do foco ectópico (RS1 e RS2). RS1 durou 3.000 ms e RS2 durou 4.000 ms. Rotores com maior estabilidade espaço-temporal: o modelo matemático celular de Loewe17 foi implementado em todo o átrio. Três grupos de células na parede anterior do átrio foram ativados duas vezes, com frequência de 7 Hz, densidade de corrente de 250 µA/cm2 e duração de 2 ms. As simulações foram realizadas com diferentes condutividades no tecido, com gil e git iguais a 0,14 S/m e gel e get iguais a 0,7 S/m sendo multiplicadas por fatores iguais a 1 (RS3), 0,8 (RS4), 0,5 (RS5) e 0,3 (RS6). Essas simulações duraram 3.000 ms.
Simulações do Mecanismo da FA: Múltiplas Reentradas
Três simulações de múltiplas reentradas foram conduzidas utilizando o mesmo procedimento de indução de mecanismo. No entanto, cada simulação diferiu nas considerações relativas à fibrose no tecido. Na primeira simulação (MWS1) a fibrose não foi considerada. Na segunda simulação (MWS2), foi inserida região fibrótica em 15% do apêndice atrial e septo interatrial. Por fim, na terceira simulação (MWS3), uma região fibrótica de 30% foi adicionada às mesmas regiões do apêndice atrial e do septo interatrial. O método utilizado para induzir múltiplas reentradas envolveu a seleção de quatro grupos de células distribuídas na parede posterior do átrio com espaçamento entre eles. Os grupos celulares foram estimulados simultaneamente, mas em cada grupo algumas células foram estimuladas durante o período refratário das células vizinhas, enquanto outras foram despolarizadas sem tecido refratário em sua volta. O modelo celular de Loewe17 foi utilizado em todas as simulações. Porém, para MWS2 e MWS3, além dessa variante que modela o PA, foi utilizada outra variante representando os efeitos causados pelas citocinas nas regiões fibróticas do apêndice e septo interatrial15. A condutividade foi fixada em 0,174 S/m para gil e git, e 0,625 S/m para gel e get, sendo multiplicadas por um fator de 0,3 em todas as simulações. Porém, em MWS2 e MWS3, a porcentagem de elementos fibróticos apresentou condutividade muito baixa de 10-7 S/m. O estímulo sinusal foi mantido ao longo das simulações, sendo que o estímulo que despolariza os quatro grupos de células possui densidade de corrente de 250 µA/cm2, duração de 2 ms e frequência de 8 Hz, disparando duas vezes. As simulações MWS1, MWS2 e MWS3 duraram 5.000 ms.
Os Resultados obtidos a partir das simulações dos mecanismos da FA
Todas as simulações realizadas podem ser visualizadas através do link: https://www.youtube.com/playlist?list=PLom9zID5FoVHx9UP8pEYvFX1tGW-feZxx. Visualmente, os mecanismos simulados foram categorizados com base em suas características morfológicas distintas. Os focos ectópicos foram identificados por ativações oriundas de uma região diferente do nó sinoatrial, gerando a propagação de uma onda radial característica. Em relação aos rotores, foi observada uma estrutura em formato de espiral com núcleo quase inexcitável e a velocidade da frente de onda diminuiu gradativamente à medida que se aproximava do centro. Por outro lado, nas múltiplas reentradas foi observada a colisão de diversas frentes de onda, que, após a colisão, se propagaram em diferentes direções.
A Figura 2A mostra a simulação PWS representando um ritmo atrial normal. A Figura 2B mostra a simulação EF1, onde um foco ectópico é sobreposto ao estímulo sinusal e localizado na crista terminal. Ao analisar as simulações de foco ectópico, notou-se que, mesmo com frequência de disparo focal de 7 Hz, o tecido não foi completamente despolarizado na mesma frequência, devido ao período refratário das células modeladas com base no modelo de Courtemanche. Nas células presentes no foco ectópico há um encurtamento do período refratário aumentando a probabilidade de eventos de FA, como reentradas, o que apoia o conceito bem conhecido de que a FA pode se perpetuar, criando um ciclo de auto-reforço (“FA gera FA”).
Nas simulações do rotor, a principal causa subjacente do mecanismo observado foi o bloqueio da frente de onda, resultando na ausência de propagação radial da ativação anterior ao mecanismo. A Figura 2C (simulação RS6) ilustra esse bloqueio causado pela refratariedade do tecido circundante, que permitiu que o estímulo se propagasse apenas em duas direções distintas, dando origem à formação de dois rotores. Adicionalmente, observou-se que a variante do modelo Courtemanche17, aplicada em todo o átrio (simulações RS3, RS4, RS5 e RS6), sustentou o mecanismo por um período maior em comparação à simulação em que esta variante foi aplicada apenas para uma região na parede anterior do átrio (como na simulação RS1, ilustrada na Figura 2D).
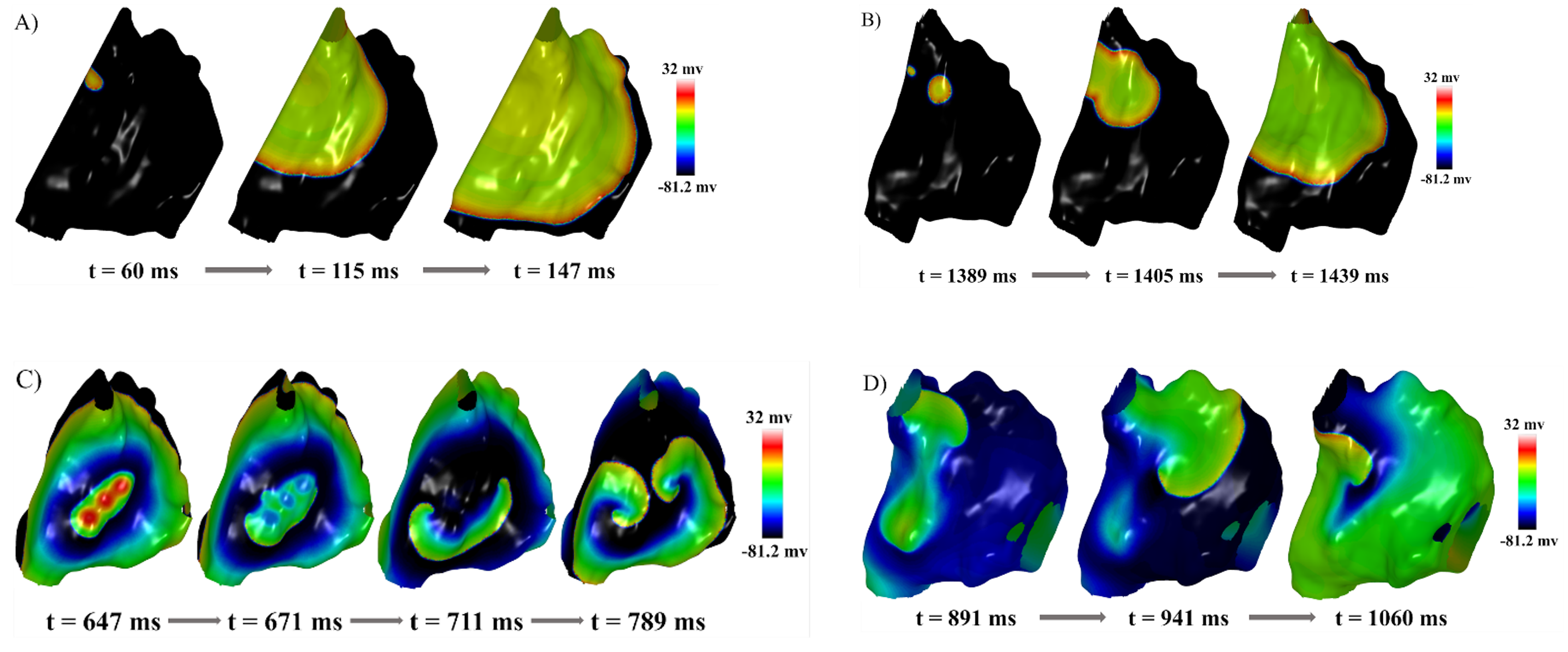
Figura 2. Simulações representativas dos mecanismos da FA. Esta figura ilustra momentos selecionados de diferentes simulações, cada uma demonstrando um cenário distinto. Em A observa-se a simulação de uma onda planar PWS, enquanto em B apresenta a simulação de foco ectópico EF1. Em C, a simulação de rotor RS6 é destacada, seguida pela simulação de rotor RS1 em D.
As simulações de múltiplas reentradas seguiram um caminho semelhante às simulações do rotor na indução do mecanismo. Ao introduzir mais grupos de células a serem estimuladas e aumentar o espaçamento entre elas, observou-se um aumento na ocorrência de bloqueios de frente de onda, resultando na propagação dessas ondas em diferentes direções ao invés de se espalharem radialmente. Este cenário facilitou a indução de múltiplas reentradas em diversas direções, como visto na Figura 3.
A maior distância entre os grupos de células permitiu que enquanto uma vizinhança do grupo não pudesse ser despolarizada, a outra região vizinha pudesse ser despolarizada, encontrando tecido fora do período refratário. Isso gerou uma pequena frente de onda que se propagou em espiral e colidiu com outras pequenas frentes de onda, geradas da mesma forma, propagando assim múltiplas frentes de onda reentrantes. O mecanismo só foi sustentado por um período prolongado quando havia um número considerável de frentes de onda iniciais anteriores ao mecanismo. Nas simulações MWS2 e MWS3 disponíveis através do link acima, é inserido uma regiãos fibrótica tendo suas células um período refratário prolongado não conseguindo se despolarizar na mesma velocidade que o restante do tecido vizinho durante a arritmia.
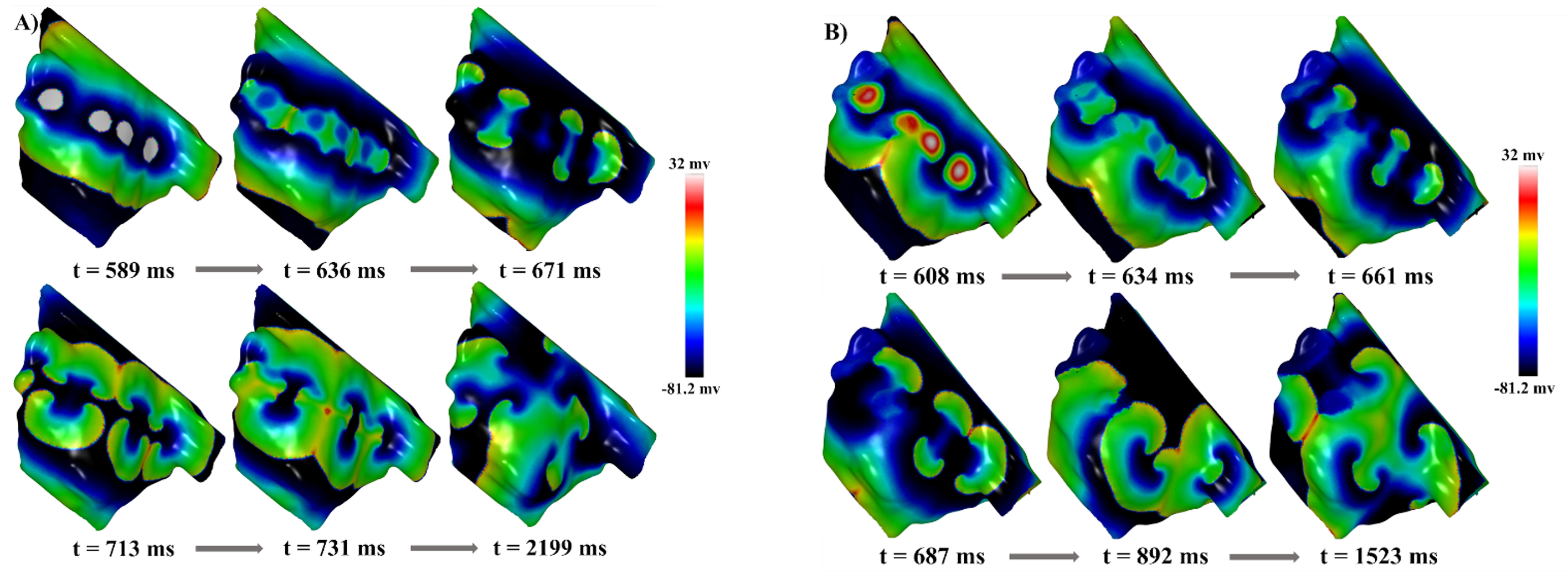
Figura 3. Simulações de Múltiplas Reentradas. A) Uma simulação que apresenta a simulação de múltiplas reentradas MWS1, e em B) a simulação de múltiplas reentradas MWS3.
Aspectos importantes a serem destacados
Para o entendimento desta complexa arritmia, e contribuir para tratamento eficazes dos pacientes com FA, pesquisas translacionais são de suma importância. Os modelos experimentais com animais visam reproduzir a arritmia em ambiente controlado e desvendar caracteristicas ainda desconhecidas sobre seus mecanismos de início e propagação, incluindo a dinâmica complexa das formas de propagação das frentes de ondas nos átrios, que uma vez conhecidas, podem serem interrompidas, por procedimentos invasivos, aumentando as taxas de sucesso de tratamento. Também, os modelos experimentais têm possibilidado o desenvolvimento de novas técnicas acuradas de mapeamento da atividade elétrica16 e de tratamento, sugerindo aprimoramentos nos equipamentos médicos e seus sistemas, utilizados em pacientes para o disgnóstico e tratamento da FA.
No entanto, essas intervenções sempre estão associadas a vida, no caso de um animal. Sendo assim sempre que possível formas alternativas devem ser buscadas, sendo a mais utilizada as computacionais. As simulações computacionais têm mostrado grande avanço no entendimento da FA em todo o mundo, contribuindo sem precedentes com os médicos e pesquisas translacionais. Através dela está sendo possível reproduzir os fenômenos e características observadas nos pacientes através de sofisticados modelos matemáticos e avançados recursos computacionais. Diferentes modelos celulares têm sido desenvolvidos, e características do remodelamento atrial observados em pacientes simulados. Uma vez que a complexidade da FA tem sido simulada, pesquisadores têm avançado no manejo desta doença através da simulação da administração de medicamentos disponíveis para assim entender o desfecho da arritmia sob o efeito destas drogas, e identificar os mais eficazes com menos fatores de riscos.
O presente estudo utilizou simulações computacionais para investigar os mecanismos subjacentes à FA, uma arritmia cardíaca complexa e clinicamente relevante. Através da categorização visual dos mecanismos simulados, é possível apoiar as teorias de focos ectópicos, rotores e reentradas múltiplas como gatilhos para FA.
A análise das simulações de foco ectópico revelou que mesmo com uma frequência de disparo relativamente alta, o tecido não foi completamente despolarizado devido ao período refratário das células baseado no modelo de Courtemanche. Adicionalmente, houve um encurtamento do período refratário das células, o que pode aumentar a probabilidade de eventos de FA, como reentradas, reforçando a conhecida ideia de que “FA gera FA”.
Nas simulações do rotor, descobrimos que a aplicação da variante Loewe em todo o átrio sustentou o mecanismo por um período mais longo em comparação com a aplicação desta variante apenas em uma região específica. Além disso, a presença de heterogeneidade nos modelos iônicos e de condutividade entre as diferentes regiões do átrio pode explicar a maior desorganização e o padrão característico de fibrilação observados em algumas simulações de rotores.
As simulações de múltiplas reentradas seguiram uma lógica semelhante às simulações do rotor na indução do mecanismo. O aumento do número de grupos celulares estimulados e o espaçamento entre eles facilitaram a formação de múltiplas frentes de ondas reentrantes, essenciais para o estabelecimento da FA. Adicionalmente, observou-se que o mecanismo de múltiplas reentradas foi melhor simulado quando um número considerável de frentes de onda em diferentes direções colidiram para dar origem ao mecanismo.
A inserção de uma região fibrótica no tecido causou alterações na propagação da ativação elétrica, resultando em picos de pequena amplitude no sinal do potencial transmembrana nas bordas da região fibrótica. Essa resposta eletrofisiológica sugere que a presença de fibrose afeta a condução elétrica local, contribuindo para a formação de padrões arritmogênicos.
Os achados confirmam que as simulações computacionais são uma ferramenta viável e valiosa para investigar os mecanismos da FA, com enorme potencial para investigação em eletrofisiologia cardíaca, ajudando a compreender melhor os padrões de ativação em corações saudáveis e arrítmicos, proporcionando uma interpretação muito mais profunda dos dados experimentais e de pacientes. Esses modelos podem ser usados para compreender mecanismos arrítmicos, validar terapias, testar os resultados de intervenções e personalizar tratamentos.
Agradecimentos
A pesquisa desenvolvida contou com o envolvimento direto da UFABC, de diversas formas, incluindo a bolsa de PDPD (Edital: No. 11/2022 - PROPES (11.01.07), Protocol: 23006.016671/2022-51) do aluno Felipe Fonseca. Também através da disponibilização do espaço de laboratório, mobiliários, computador, e assistência técnico-administrativa. Este projeto também contou com o apoio da Fundação de Amparo à Pesquisa de São Paulo, Projeto Jovem Pesquisador 2018/25606-2 e do CNPq através do INCT INTERAS.
Prêmios
1º lugar no XIII Encontro de Iniciação Científica, eixo Simulação e Representaçao.
2º lugar no prêmio de Melhor Trabalho de Graduação do XV Simpósio de Engenharia Biomédica. Uberlândia, Brasil. Setembro-2023.
Referências Bibliográficas
- Kirchhof, P. et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. European Heart Journal 38, 2893-2962 (2016).
- Olmos, R.D. Fibrilação atrial aguda na emergência. Ann Emerg Med Oct 52, 322-28 (2008).
- Bollmann, A. & Lombardi, F. Electrocardiology of atrial fibrillation: current knowledge and future challenges. IEEE Eng Med Biol Magazine 25(6): 15-23 (2016).
- Lilly, L.S. Pathophysiology of heart disease: a collaborative project of medical students and faculty: (Lippincott Williams & Wilkins, 2012).
- Wodchis, W. P., Bhatia, R. S., Leblanc, K., Meshkat, N., Morra, D. A Review of the Cost of Atrial Fibrillation. Value in Health 15(2): 240-8 (2012).
- Naser, N. et al. The Cumulative Incidence of Stroke, Myocardial infarction, Heart Failure and Sudden Cardiac Death in Patients with Atrial Fibrillation. Med Arch 71(5): 316-9 (2017).
- SBC. II Diretrizes brasileiras de fibrilação atrial. Sociedade Brasileira de Cardiologia. Arq Bras Cardiol 106(4 supl 2): 1-22 (2016).
- Aldhoon, B. et al. New insights into mechanisms of atrial fibrillation. Physiological research 59 (1):1-12 (2010).
- Crandall, M. A. et al. Contemporary management of atrial fibrillation: update on anticoagulation and invasive management strategies. Mayo Clinic Proceedings 84:643662 (2009).
- Craig, T. J. et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the management of patients with atrial fibrillation: A Report of the American College of Cardiology/American Heart Association task force on clinical practice guidelines and the Heart Rhythm Society. JAAC 74(1): 104-32 (2019).
- DÖSSEL, O. et al. Computational modeling of the human atrial anatomy and electrophysiology. Medical & biological engineering & computing, Springer, v. 50, n. 8, p. 773–799, 2012.
- DÖSSEL, O. et al. Atrial Signals – Modeling Meets Biosignal Analysis. In: EMBEC & NBC 2017. Singapore: Springer Singapore, 2018. p. 723–726.
- DÖSSEL, O. et al. Computerized modeling of the human heart. Zeitschrift fur medizinische Physik, v. 27, n. 3, p. 167, 2017.
- Plank, G. et al. The openCARP simulation environment for cardiac electrophysiology. Comput Methods Programs Biomed 208:106223 (2021).
- Roney, C. H. et al. Modelling methodology of atrial fibrosis affects rotor dynamics and electrograms. Europace 18(suppl 4) :iv146-iv155 (2016).
- Courtemanche, M. et al. Ionic mechanisms underlying human atrial action potential properties: insights from a mathematical model. Am J Physiol 275(1): H301-21 (1998).
- Loewe, A. et al. Influence of chronic atrial fibrillation induced remodeling in a computational electrophysiological model. Biomedical Engineering 59(suppl 1):S929--S932 (2014).
- Campos, J. O. Método de lattice Boltzmann para simulação da eletrofisiologia cardíaca em paralelo usando GPU. Mestrado, Universidade Federal de Juiz de Fora (2015).
- Salinet, J. et al. 3D Electrical Mapping of the Heart. In: Christiane Bertachini Lombello; Patricia Aparecida da Ana. (Org.). Current Trends in Biomedical Engineering. 1ed.: Springer, Cham, 2023, v. , p. 237-253.



Redes Sociais